Zielgerichtete Krebstherapie: Das Tumorwachstum punktgenau hemmen
Wie wirkt eine "targeted therapy"? Wem nützt sie?
Zielgerichtete Arzneimittel richten sich gegen Eigenschaften der Krebszellen, die für das Tumorwachstum wichtig sind. Sie sind auf biologische Merkmale des Tumors ausgerichtet. Nur wenn die Tumorzellen diese Merkmale haben, kann die Behandlung nützen.
Sie erfahren in diesem Text, für wen eine gezielte Krebstherapie geeignet ist und wie sie abläuft. Außerdem ist erläutert, welche Medikamente es gibt und welche Nebenwirkungen sie haben können.
Gezielte Krebstherapie: Wichtiges in Kürze

Zielgerichtete Krebstherapie oder auch (engl.) targeted therapy: So nennt man die Behandlung mit Medikamenten, die gezielt in Vorgänge eingreifen, die für das Tumorwachstum wichtig sind. Inzwischen gibt es viele verschiedene dieser modernen Krebsmedikamente.
Ob eine solche Behandlung infrage kommt, hängt von mehreren Faktoren ab, zum Beispiel
- von der Tumorart, an der man erkrankt ist,
- vom Krankheitsstadium
- und von den biologischen Merkmalen der eigenen Krebszellen.
Krebspatienten sollten mit ihren behandelnden Ärzten darüber sprechen, ob eine zielgerichtete Krebstherapie für sie geeignet ist. Eine Information aus dem Internet kann ein solches Gespräch nicht ersetzen.
Die Wirkstoffe erhält man als Infusion oder Tablette, manche auch als Spritze unter die Haut. Bei einigen Betroffenen werden sie mit anderen Therapien kombiniert, zum Beispiel mit einer Chemotherapie.
Die Arzneimittel richten sich zwar gezielt gegen Eigenschaften der Tumorzellen. Dennoch haben auch zielgerichtete Therapien Nebenwirkungen. Denn die Strukturen, auf die die Wirkstoffe zielen, kommen teilweise auch in gesunden Zellen vor. Typisch sind zum Beispiel Nebenwirkungen an der Haut, am Herz und auf den Blutdruck. Auch Schilddrüse, Leber und Magen-Darm-Trakt können betroffen sein.
Therapieplanung: Für wen kommt die Behandlung infrage?
Zielgerichtete Wirkstoffe werden zur Behandlung verschiedenster Krebserkrankungen eingesetzt. Sie eignen sich zum Beispiel für einige Betroffene mit Brust-, Lungen- oder Darmkrebs und für manche Patientinnen oder Patienten mit Leukämie. Nicht für jede Krebsart stehen allerdings zielgerichtete Therapien zur Verfügung.
Die meisten der Medikamente sind für die Behandlung einer fortgeschrittenen Erkrankung zugelassen. Das bedeutet: Sie kommen zum Einsatz, wenn eine Heilung der Krebserkrankung nicht mehr möglich ist. Die Arzneimittel können dann das Fortschreiten der Erkrankung aufhalten und Beschwerden lindern. Es gibt aber auch zielgerichtete Medikamente, die für frühe Krankheitsstadien geeignet sind: zum Beispiel bei Brustkrebs.
Weitere zielgerichtete Medikamente und die Wirkung bei anderen Tumorarten oder in anderen Krankheitsstadien werden gerade in klinischen Studien geprüft.
Sind die Zielmerkmale vorhanden?

Eine zielgerichtete Krebstherapie kann nur wirken, wenn die jeweiligen Zielstrukturen auf oder in den Krebszellen vorhanden sind. Experten nennen solche Strukturen auch prädiktive Marker oder allgemeiner Biomarker ("prädiktiv" kommt aus dem Lateinischen und bedeutet "vorhersagen").
Molekulare Tests
Bei einigen Krebspatienten testen die Ärzte deshalb mit mikroskopischen Untersuchungen oder molekularbiologischen Methoden solche Marker. Das Gewebematerial für solche Untersuchungen können Ärzte bei einer Biopsie oder bei der Tumoroperation entnehmen. Bei manchen Patienten können Krebszellen für die Untersuchung auch aus dem Blut gewonnen werden.
Zulassung: Krebsart oder Biomarker entscheidend?
Im Moment werden Krebsmedikamente für die Behandlung einer bestimmten Krebsart, zugelassen, zum Beispiel Darmkrebs oder Lungenkrebs: In klinischen Studien wurde bei Patienten mit dieser Krebsart eine Wirkung gezeigt.
In Zukunft könnte sich das ändern: Manche Medikamente könnten dann zur Behandlung von Krebspatienten zugelassen werden, bei denen ein bestimmter Biomarker auf oder in Krebszellen nachgewiesen wurde. An welcher Krebserkrankung genau der Betroffene erkrankt ist, spielt dann keine Rolle. Erste solche Zulassungen gibt es bereits in den USA.
Allein oder in Kombination?
Einige Patienten erhalten die zielgerichtete Therapie kombiniert mit einer anderen Therapieform. Das kann eine Chemotherapie, eine Hormontherapie oder eine Strahlentherapie sein. Es gibt auch die Möglichkeit, mehrere zielgerichtete Medikamente miteinander zu kombinieren.
Durchführung: So läuft eine zielgerichtete Krebstherapie ab
Wo behandeln? Die meisten Patientinnen und Patienten können eine zielgerichtete Therapie ambulant oder zu Hause durchführen. Eine ambulante Therapie kann in der Praxis niedergelassener Fachärztinnen und Fachärzte für Krebsmedizin oder in der Ambulanz einer Klinik stattfinden.
- Bei einer ambulanten Behandlung sollte man klären, wie man zur Therapie und wieder zurückkommt. Es kann sein, dass man nach der Behandlung nicht selbst fahren, sondern sich zumindest begleiten lassen sollte. Können das Angehörige oder Freunde nicht übernehmen? Dann besteht die Möglichkeit, sich einen Krankentransport verordnen zu lassen, mehr dazu unter Mobil trotz Krebs: Von A wie Autofahren bis Z wie Zuzahlung zum Krankentransport.
- Ist der Allgemeinzustand sehr schlecht oder besteht ein erhöhtes Risiko für Komplikationen, dann kann eine stationäre Behandlung geeigneter sein.
Wie behandeln? Die zielgerichteten Medikamente erhält man als Infusion in eine Vene, als Tabletten oder als Spritze unter die Haut. Ob es möglich ist, zu Hause Tabletten einzunehmen oder ob man ambulant Infusionen oder Spritzen bekommt, hängt vom Medikament ab, das man bekommt.
Ist absehbar, dass man häufig und über längere Zeit Infusionen erhalten wird, empfehlen Ärzte einen Port. Dann muss nicht jedes Mal wieder neu in eine Vene gestochen werden. Ein Port ist ein kleines Kunststoff-Reservoir unter der Haut, das mit einer großen Vene verbunden ist. Die Ärzte setzen es bei einem ambulanten Eingriff unter örtlicher Betäubung unter die Haut. Über den Port erhält man anschließend die Infusionen.
Wechselwirkungen mit anderen Medikamenten und Nahrungsmitteln
Zielgerichtete Medikamente können Wechselwirkungen mit anderen Medikamenten eingehen: Medikamente können dann schlechter wirken oder mehr Nebenwirkungen haben. Vor der Therapie sollte man deshalb mit seinen Ärzten besprechen, welche Medikamente man wie gewohnt weiter einnehmen kann und wo eventuell ein Umstieg auf ein anderes Präparat oder eine Einnahmepause ratsam wäre.
- Ohne Rücksprache mit den behandelnden Ärzten sollten Sie weder Medikamente eigenmächtig absetzen, noch neue Präparate einnehmen. Das gilt auch für frei verkäufliche Medikamente oder Nahrungsergänzungsmittel.
Auch Wechselwirkungen mit den Mahlzeiten sind möglich: Nahrungsmittel können beeinflussen, wie der Körper zielgerichtete Medikamente aufnimmt und verarbeitet. Davon hängt die Wirksamkeit ab.
- Bei Tabletten sollten Sie sich genau an die Einnahme-Empfehlungen Ihres jeweiligen Medikaments halten. Informieren Sie sich, ob sie das Medikament vor, zu oder nach den Mahlzeiten einnehmen müssen.
Wie häufig bekommt man die Medikamente?
Die Therapie folgt in der Regel einem bestimmten Schema. Das bedeutet: Man erhält das Medikament oder die Medikamente in festgelegten Abständen. Viele Tabletten muss man zum Beispiel täglich einnehmen, eine oder mehrere gleichzeitig. Infusionen erhält man wöchentlich, oder auch alle zwei oder drei Wochen. Eine einzelne Infusion dauert in der Regel eine halbe bis zwei Stunden. Erhält man gleichzeitig eine Chemotherapie, dann können am selben Tag weitere Infusionen hinzukommen.
Wie lange dauert die Behandlung insgesamt?
Betroffene mit fortgeschrittener Erkrankung erhalten die Medikamente in der Regel solange wie sie wirken, oder bis nicht akzeptable Nebenwirkungen auftreten. In anderen Krankheitsstadien hängt die Behandlungsdauer davon ab, welches Medikament man bekommt und an welcher Krebsart man erkrankt ist.
Nebenwirkungen: Mit welchen Therapiefolgen muss man rechnen?
Zielgerichtete Medikamente wirken spezifischer auf die Krebszellen als zum Beispiel viele Arzneimittel zur Chemotherapie. Dennoch gilt: Auch diese Wirkstoffe haben Nebenwirkungen. Denn ihre Angriffsziele kommen auch auf gesunden Zellen vor, wenn auch in geringerer Menge.
Mit welchen Nebenwirkungen man rechnen muss, hängt vom Medikament oder den Medikamenten ab, die man bekommt. Auch wirken die Arzneimittel nicht bei jedem gleich.
Haut, Haare und Nägel
Das kann passieren: Einige Patienten entwickeln Nebenwirkungen an der Haut oder den Nägeln. Das können zum Beispiel Rötungen, Pusteln, Juckreiz, Entzündungen oder Verhornungen sein. Haare können brüchig werden oder ausfallen. Diese Symptome treten bei manchen Patienten nach Tagen, bei anderen erst Wochen oder Monate nach Beginn der Therapie auf. Sie können sehr belastend sein.
Das lässt sich dagegen tun: Schon vor Beginn der Behandlung kann man Hautbeschwerden vorbeugen – zum Beispiel mit einer rückfettenden harnstoffhaltigen Basispflege der Haut. Während der Behandlung sollte man beispielsweise mechanische Belastungen der Haut, unnötiges Waschen, Make-up, hohe Raumtemperaturen und direkte Sonneneinstrahlung möglichst vermeiden. Arzt oder Ärztin geben weitere Hinweise und empfehlen, wenn notwendig, eine Behandlung der jeweiligen Beschwerden. Mehr dazu in unserem Informationsblatt: Medikamentöse Tumortherapien: Nebenwirkungen an Haut und Nägeln (PDF).
- Die Veränderungen bilden sich in der Regel zurück, wenn die Behandlung vorbei ist.
Herz und Blutkreislauf
Das kann passieren: Wirkstoffe, die die Blutgefäßneubildung hemmen, können Nebenwirkungen auf das Herz-Kreislaufsystem haben. Dazu gehört die Bildung von Blutgerinnseln (Thrombosen) oder Bluthochdruck.
Das lässt sich dagegen tun: Je nach Risiko überwachen die Ärzte Herzfunktion und Blutdruck. Treten Symptome auf, können Betroffene mit Medikamenten behandelt werden.
Durchfall
Das kann passieren: Manche Patientinnen und Patienten leiden unter Durchfall während der Therapie mit zielgerichteten Medikamenten.
Das lässt sich dagegen tun: Man sollte auf eine ausreichende Flüssigkeitszufuhr achten – empfohlen werden drei bis vier Liter zucker- und salzhaltiges Wasser. Es gibt verschiedene Medikamente, die die Ärzte empfehlen können. Auch eine Umstellung der Ernährung kann helfen. Diese sollte man allerdings mit dem Arzt oder der Ärztin besprechen.
Schilddrüse, Leber
Das kann passieren: Weitere mögliche Nebenwirkungen sind beispielsweise eine Fehlfunktion der Schilddrüse oder eine Schädigung der Leber.
Das lässt sich dagegen tun: Nehmen Patienten Medikamente ein, bei denen solche Nebenwirkungen bekannt sind, überwachen Ärzte die Funktion von Schilddrüse und Leber der Betroffenen regelmäßig.
Sprechen Sie mit Ihren Ärzten!
- Mit den behandelnden Ärztinnen und Ärzten sollten Sie schon vorab über mögliche Nebenwirkungen sprechen.
- Wenn Sie Nebenwirkungen während der Therapie mit einem zielgerichteten Medikament bemerken, sollten Sie das ebenfalls mit Ihren Ärzten besprechen.
- Diese können Sie beraten, was Sie tun können, um Nebenwirkungen vorzubeugen oder Beschwerden zu lindern und welche Medikamente und zusätzlichen unterstützenden Maßnahmen infrage kommen.
- Sind die Nebenwirkungen zu stark, dann muss eventuell die Therapie unterbrochen werden. Nur selten muss sie ganz beendet werden.
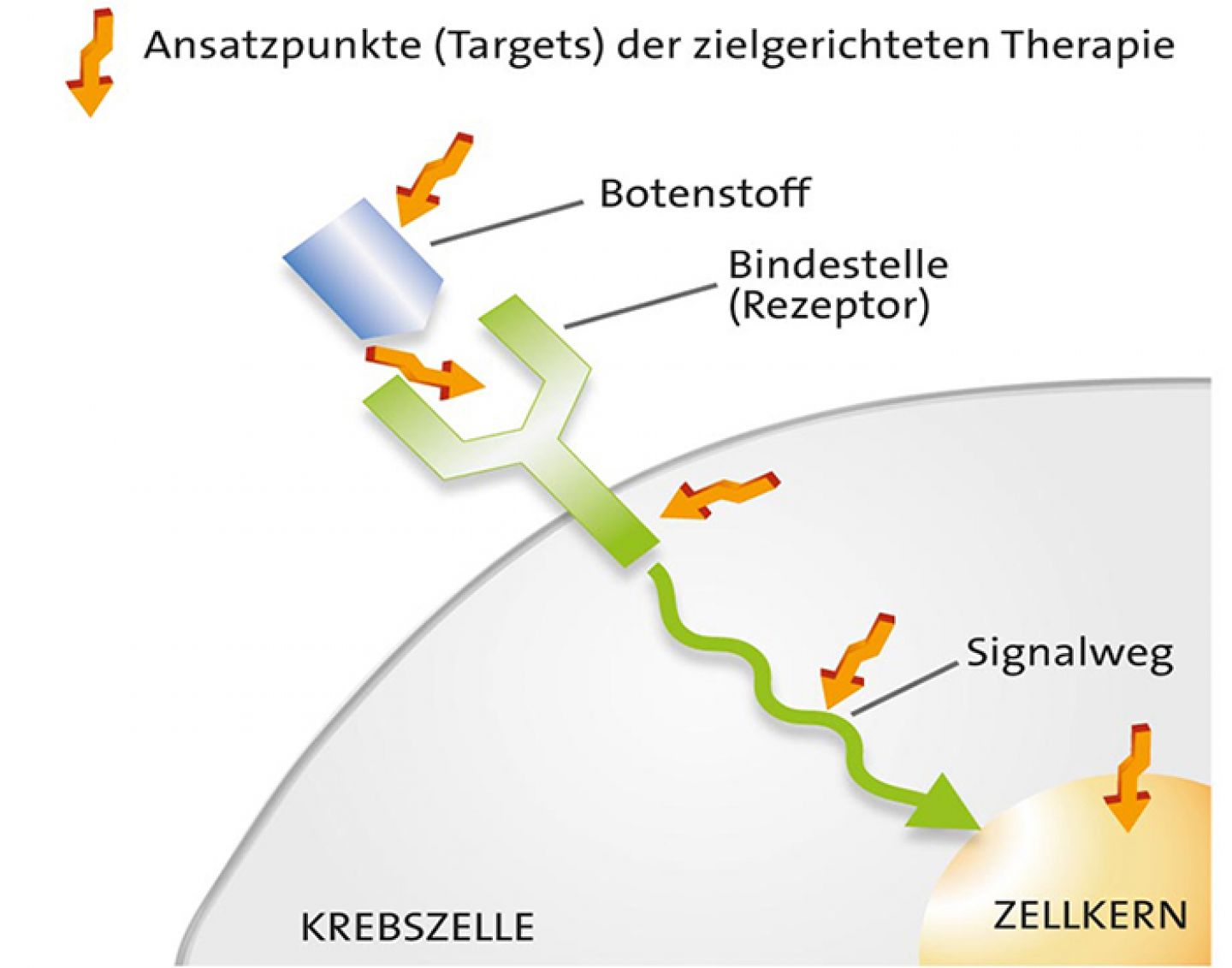
Zielgerichtete Medikamente: So wirken sie auf die Krebszellen
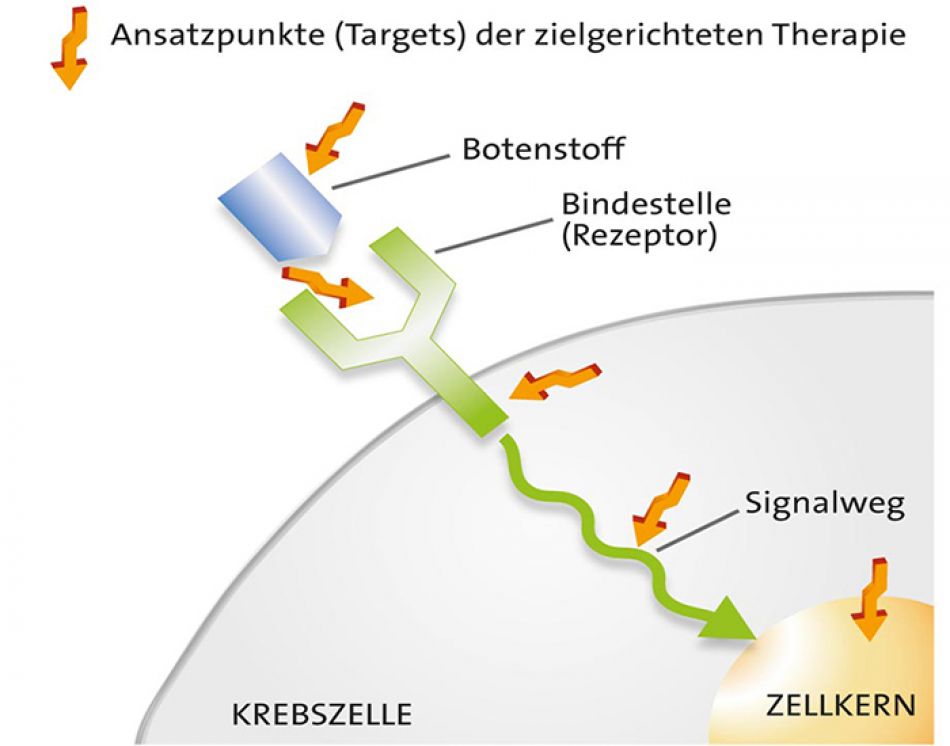
Zielgerichtete Arzneimittel greifen in Abläufe ein, die für das Krebswachstum wichtig sind. Sie sind auf bestimmte Eigenschaften der jeweiligen Tumorzellen ausgerichtet:
- Diese Zielstrukturen können zum Beispiel auf der Zelloberfläche liegen (Angriffspunkt: Rezeptor).
- Manchmal handelt es sich auch um Moleküle, die Signale an Krebszellen übertragen. Diese kann man gezielt abfangen (Angriffspunkt: Botenstoff).
- Andere Wirkstoffe dringen in die Krebszellen ein und blockieren dort wichtige Signale (Angriffspunkt: Signalweg).
Fragen Sie uns!
Angesichts der großen Zahl inzwischen verfügbarer Mittel können hier nicht alle aufgeführt werden. Fragen zu Substanzen und Markennamen beantwortet der Krebsinformationsdienst deshalb am Telefon oder per E-Mail.
Wachstums-Hemmstoffe: Teilung und Wachstum von Krebszellen unterdrücken
Zellwachstum und -vermehrung sind im Körper normalerweise streng reguliert:
- Zellen wachsen und teilen sich nur dann, wenn sie von außen dazu angeregt werden: durch Botenstoffe, sogenannte Wachstumsfaktoren.
- Diese Botenstoffe binden an Schaltstellen auf der Zelloberfläche oder im Zellinneren, sogenannte Rezeptoren.
- Die Rezeptoren geben das Wachstumssignal in der Zelle weiter, wo es in mehreren Schritten weitergeleitet wird.
- Diese Signalübertragungskette führt am Ende dazu, dass die Zelle wächst oder sich teilt.
In Krebszellen kann die Signalübertragung an verschiedenen Stellen verändert sein. Diese Stellen sind mögliche Angriffsziele der Krebsmedikamente.
Rezeptoren auf der Zelloberfläche blockieren: Große Eiweißmoleküle, die passgenau an bestimmte Strukturen binden, heißen monoklonale Antikörper. Sie können zum Beispiel Rezeptoren auf der Zelloberfläche besetzen und so die Bindung von Wachstumsfaktoren verhindern. Die Zellen erhalten kein Signal mehr zur Teilung. Ein Beispiel ist Trastuzumab. Dieser Antikörper richtet sich gegen den Wachstumsrezeptor HER2, der beispielsweise bei einem Teil der Brust- und Magenkrebspatienten verstärkt ausgebildet wird. Antikörper erhält man als Infusion in eine Vene.
Rezeptoren im Zellinneren blockieren: Rezeptoren ragen nicht nur nach außen, sondern auch ins Zellinnere. So können sie das Signal von außen nach innen in die Zelle weiterleiten. Diesen Vorgang kann man ebenfalls blockieren: Mit Medikamenten, die in die Zellen einwandern und von innen an den Rezeptor binden. Die Signale selbst werden von Eiweißen übertragen. Man nennt sie auch Kinasen. Medikamente, die Kinasen blockieren heißen deshalb Kinasehemmer. Man kann sie in der Regel als Tablette schlucken. Beispiele sind die Wirkstoffe Gefitinib und Erlotinib, die zum Beispiel Betroffene mit Lungenkrebs erhalten.
Signalübertragungsketten stören: Die schrittweise Weiterleitung der Signale im Zellinneren funktioniert ebenfalls zum großen Teil über die sogenannten Kinasen. Auch sie können von zielgerichteten Wirkstoffen – Kinasehemmern – blockiert werden. Es gibt verschiedene Kinasen:
- Das häufigste Angriffsziel sind Tyrosinkinasen, Beispiel für einen Hemmstoff ist Imatinib, den manche Betroffene mit einer Leukämie erhalten.
- Ein weiteres Beispiel ist die mTOR-Kinase, die von mTOR-Hemmern wie Everolimus gehemmt wird. Diesen Wirkstoff bekommen beispielsweise manche Brustkrebspatientinnen.
- Hemmt ein Medikament mehrere Kinasen, spricht man von einem Multikinasehemmer. Hierzu gehört beispielsweise Sorafenib, das Patienten mit Leber- oder Nierenkrebs erhalten können.
Hemmstoffe der Blutgefäßbildung: Die Nahrungsversorgung des Tumors stören
Wachsende Tumoren benötigen wie andere Gewebe eine Versorgung mit Sauerstoff und Nährstoffen über Blutgefäße. Tumorzellen können selbst die Bildung neuer Blutgefäße anregen, die sogenannte Angiogenese. Dafür bilden sie zum Beispiel Botenstoffe wie den "vaskulären Endothelwachstumsfaktor", abgekürzt VEGF (englisch: vascular endothelial growth factor).
Es gibt Medikamente, die eine Neubildung von Blutgefäßen stören und so verhindern , dass der Tumor weiterwächst. Man bezeichnet sie als Angiogenesehemmer. Auch unter diesen Medikamenten gibt es Antikörper und Kinasehemmer. Ein Beispiel ist der Antikörper Bevacizumab, den man zum Beispiel als Brust- oder Darmkrebspatient erhalten kann. Sunitinib ist ein Beispiel für einen Kinasehemmer, der die Signalweiterleitung vom VEGF-Rezeptor blockiert.
Körpereigene Abwehr: Das Immunsystem auf den Tumor ansetzen
Zielgerichtete Antikörper lösen unter anderem auch eine Immunreaktion aus. Das bedeutet: Das körpereigene Immunsystem erkennt die Tumorzellen selbst und bekämpft sie. Das ist allerdings nicht die Hauptwirkung der meisten zielgerichteten Medikamente. Sie wurden eher dazu entwickelt, gezielt in Signalübertragungswege einzugreifen.
Sonderfall Immun-Checkpoint-Hemmer: Diese Medikamente richten sich gegen körpereigene "Bremsen" im Immunsystem und verhindern so eine Unterdrückung der Immunantwort durch die Tumorzellen. Man rechnet sie daher den Immuntherapien zu. Ein Beispiel ist der Antikörper Ipilimumab, den beispielsweise Patienten mit schwarzem Hautkrebs erhalten können.
Antikörper als Transportmittel: Zellgifte gezielt zur Krebszelle lenken
Antikörper kann man auch nutzen, um gezielt Zellgifte zu den Tumorzellen zu bringen. Dafür koppelt man sie an Giftstoffe oder radioaktive Substanzen, die ihre Wirkung erst an oder in den Krebszellen entfalten. Die Antikörper binden an spezifische Merkmale der Tumorzellen und bringen so ihre Fracht ans Ziel.
Die gekoppelte Substanz kann beispielsweise ein Chemotherapie-Medikamente (Zytostatikum) sein, das in die Bildung wichtiger Eiweißmoleküle eingreift. Ein Beispiel ist Trastuzumab-Emtansin: Der Antikörper Trastuzumab ist an die zytotoxische Substanz Mertansin gekoppelt. Trastuzumab-Emtansin wird für manche Patientinnen mit Brustkrebs eingesetzt.
Hemmung von Enzymen: Gezielte Beeinflussung wichtiger Vorgänge in der Krebszelle
Enzyme sind Moleküle, die wichtige Vorgänge in der Zelle steuern, beispielsweise die Reparatur und die Ablesehäufigkeit des Erbmaterials oder die Entsorgung von nicht mehr benötigten Eiweißen. Manche dieser Vorgänge sind in Krebszellen besonders störanfällig. Deshalb versucht man, diese gezielt mit Medikamenten zu hemmen.
Die Müllentsorgung der Zelle blockieren: Das ist die Funktion sogenannter Proteasom-Hemmer. Krebszellen produzieren viel mehr Eiweißmoleküle als gesunde Zellen und reagieren deshalb empfindlicher auf eine Proteasom-Hemmung. Sie ersticken an ihrem eigenen Abfall. Beispiel für einen Wirkstoff ist Bortezomib, das zum Beispiel Betroffene mit einem multiplen Myelom erhalten können.
Die Reparatur geschädigten Erbmaterials stören: So wirken die sogenannten PARP-Hemmer. Weil Krebszellen im Gegensatz zu gesunden Zellen keine alternativen Reparaturmechanismen zur Verfügung haben, sterben sie ab. Ein Beispiel ist Olaparib, das beispielsweise manche Betroffene mit Eierstockkrebs bekommen.
Das Selbstmordprogramm der Zellen (Apoptose) fördern: Die Krebszellen zerstören sich in der Folge selbst. Ein solcher Wirkstoff ist Venetoclax, der zur Behandlung von Patienten mit einer bestimmten Form von Leukämie zugelassen ist.
Die Ablesehäufigkeit von Genen verändern: In Krebszellen werden Gene häufig fälschlicherweise an- oder abgeschaltet. Bestimmte Enzym-Hemmer können krebshemmende Gene wieder an- und krebsfördernde Gene abschalten. Ein Beispiel ist Azacitidin, das manche Betroffenen mit einer Leukämie erhalten können.
Quellen und Links für Interessierte und Fachkreise
Sie haben Fragen zu Krebs? Wir sind für Sie da.
Haben Sie weitere Fragen zu zielgerichteten Medikamenten gegen Krebs?
So erreichen Sie uns:
- am Telefon unter 0800 – 420 30 40, täglich von 8:00 bis 20:00 Uhr, kostenlos, vertraulich
- per E-Mail an krebsinformationsdienst@dkfz.de (der Link öffnet ein gesichertes Kontaktformular)
Mehr auf unseren Internetseiten
Mikroskopische Diagnostik in der Krebsmedizin: Der Blick auf Gewebe und Zellen
Molekularbiologische Diagnostik: "High Tech" bei Untersuchung und Behandlung
Tumormarker, prädiktive Marker und Prognosefaktoren
Monoklonale Antikörper: Krebs erkennen, Krebs behandeln
krebsinformationsdienst.med: Service für Fachkreise aktuell – evidenzbasiert – unabhängig
Sie betreuen beruflich Menschen mit Krebs und haben Fragen? Mit dem Angebot krebsinformationsdienst.med unterstützt Sie der Krebsinformationsdienst bei Ihrer Arbeit, mit unabhängigen, aktuellen und qualitätsgesicherten Informationen. Der Service steht Ihnen von Montag bis Freitag zur Verfügung:
- telefonisch von 8:00 bis 20:00 Uhr unter 0800 – 430 40 50
- per E-Mail an kid.med@dkfz.de (der Link öffnet ein gesichertes Kontaktformular)
Quellen zum Weiterlesen (Auswahl)
Patientenleitlinien
Wann wird eine zielgerichtete Therapie empfohlen, wann nicht? Das fassen Fachleute heute in sogenannten Leitlinien zur Krebstherapie zusammen. Von einigen dieser Fachleitlinien existieren inzwischen auch Fassungen für Patienten. Sie sind kostenlos abrufbar im Leitlinienprogramm Onkologie, das die AWMF gemeinsam mit der Deutschen Krebsgesellschaft und der Deutschen Krebshilfe verantwortet, mehr unter www.leitlinienprogramm-onkologie.de/patientenleitlinien.
Bestellen kann man gedruckte Broschüren und Patientenleitlinien bei der Deutschen Krebshilfe. Nähere Informationen hierzu unter www.krebshilfe.de/informieren/ueber-krebs/infothek/infomaterial-kategorie/patientenleitlinien/.
Leitlinienprogramm Onkologie
Eine Zusammenstellung medizinischer Leitlinien unterschiedlicher Fachgesellschaften bietet das Leitlinienprogramm Onkologie der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF), der Deutschen Krebsgesellschaft (DKG) und der Deutschen Krebshilfe (DKH) unter www.leitlinienprogramm-onkologie.de sowie auf der Seite der AWMF unter www.awmf.org/leitlinien/. Dort sind jeweils auch die entsprechenden Patientenleitlinien abrufbar.
ÄZQ
Das Ärztliche Zentrum für Qualität in der Medizin (ÄZQ) bietet Versorgungsleitlinien und Patienteninformationen im Internet unter www.aezq.de.
DGHO
Die Deutsche Gesellschaft für Hämatologie und Onkologie (DGHO) geht auf ihren Seiten auf den Stellenwert der zielgerichteten Therapie ein. Sie stellt Fachleitlinien, Patientenleitlinien sowie Hintergrundinformationen bereit unter www.dgho.de/publikationen/onkopedia/.
AGSMO
Die Arbeitsgemeinschaft Supportive Maßnahmen in der Onkologie (AGSMO) in der Deutschen Krebsgesellschaft bietet über die Website www.onkosupport.de Patienten und Fachkreisen weiterführende Informationen zu Nebenwirkungen und zur Linderung belastender Symptome unter einer Krebserkrankung oder Krebstherapie. Wie auch die Arbeitsgemeinschaft Onkologische Rehabilitation und Sozialmedizin (AGORS) ist die AGSMO 2018 aus der früheren Arbeitsgemeinschaft Supportive Maßnahmen in der Onkologie, Rehabilitation und Sozialmedizin (ASORS) hervorgegangen.
Zentrum für Qualität in der Pflege
Das Zentrum für Qualität in der Pflege (ZQP) bietet Pflegeleitlinien in einem Online-Portal unter https://pflegeleitlinien.zqp.de.
Pharmazeutische und pharmakologische Fachinformationen
Die meisten Datenbanken zu Arzneimittelinformationen sind in Deutschland nur nach Anmeldung für Fachkreise zugänglich: Es gibt allerdings auch einige frei zugängliche Datenbanken. Einen Überblick finden Sie in unserem Ressourcen-Center für Fachkreise.
Arzneimittel: Herstellerinformationen, Zulassungen, Nutzenbewertungen
Als Quelle für Aussagen zu Medikamenten hat der Krebsinformationsdienst aktuelle Fachinformationen der Hersteller herangezogen (über www.fachinfo.de; für Fachkreise zugänglich). Arzneimittelinformationen gibt es auch in weiteren deutschsprachigen Datenbanken (überwiegend kostenpflichtig, etwa www.pharmnet-bund.de/dynamic/de/arzneimittel-informationssystem/index.html). Aktuelle Hinweise des Bundesinstituts für Arzneimittel und Medizinprodukte findet man unter www.bfarm.de sowie die Informationen der EU-Arzneimittelbehörde EMA unter www.ema.europa.eu/ema/. Zum Stellenwert neuer Arzneimittel bietet das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen evidenzbasierte Berichte ("Frühe Nutzenbewertung nach AMNOG bzw. §35a, SGB V), mehr unter www.iqwig.de/de/projekte-ergebnisse/publikationen/iqwig-berichte.1071.html.
Fachartikel
Benafif S, Hall M. An update on PARP inhibitors for the treatment of cancer. Onco Targets Ther. 2015 Feb 26;8:519-28. doi: 10.2147/OTT.S30793.
Bidard FC, Trédan O. Trends in cancer-targeted antibody-drug conjugates. Target Oncol. 2014 Mar;9(1):1-8. doi: 10.1007/s11523-013-0302-9.
Dou QP, Zonder JA. Overview of proteasome inhibitor-based anti-cancer therapies: perspective on bortezomib and second generation proteasome inhibitors versus future generation inhibitors of ubiquitin-proteasome system. Curr Cancer Drug Targets. 2014;14(6):517-36.
Fasolo A, Sessa C. Targeting mTOR pathways in human malignancies. Curr Pharm Des. 2012;18(19):2766-77.
Gutzmer R, Strumberg D. Risiko und Management von Nebenwirkungen zielgerichteter Therapien. Onkologe 2013. 19:863–869. doi: 10.1007/s00761-013-2500-6
Lee YT, Tan YJ, Oon CE. Molecular targeted therapy: Treating cancer with specificity. Eur J Pharmacol. 2018 Sep 5;834:188-196. doi: 10.1016/j.ejphar.2018.07.034.
Lipp HP. Klinisch relevante Wechselwirkungen mit peroral applizierbaren, zielgerichtet wirksamen Tumortherapeutika. Onkologe 2013. 19(10). 870-7. doi:10.1007/s00761-013-2555-4
Petrelli F, Cabiddu M, Borgonovo K, Barni S. Risk of venous and arterial thromboembolic events associated with anti-EGFR agents: a meta-analysis of randomized clinical trials. Ann Oncol. 2012 Jul;23(7):1672-9. doi: 10.1093/annonc/mdr592. Epub 2012 Jan 11.
Scott CL, Swisher EM, Kaufmann SH. Poly (ADP-ribose) polymerase inhibitors: recent advances and future development. J Clin Oncol. 2015 Apr 20;33(12):1397-406. doi: 10.1200/JCO.2014.58.8848.
Teo YL, Ho HK, Chan A. Risk of tyrosine kinase inhibitors-induced hepatotoxicity in cancer patients: a meta-analysis. Cancer Treat Rev. 2013 Apr;39(2):199-206. doi: 10.1016/j.ctrv.2012.09.004.
Yap JL, Chen L, Lanning ME, Fletcher S. Expanding the Cancer Arsenal with Targeted Therapies: Disarmament of the Antiapoptotic Bcl-2 Proteins by Small Molecules. J Med Chem. 2017 Feb 9;60(3):821-838. doi: 10.1021/acs.jmedchem.5b01888.
Wu P, Nielsen TE, Clausen MH. FDA-approved small-molecule kinase inhibitors. Trends Pharmacol Sci. 2015 Jul;36(7):422-39. doi: 10.1016/j.tips.2015.04.005.
Zahnow CA, Topper M, Stone M, Murray-Stewart T, Li H, Baylin SB, Casero RA Jr. Inhibitors of DNA Methylation, Histone Deacetylation, and Histone Demethylation: A Perfect Combination for Cancer Therapy. Adv Cancer Res. 2016;130:55-111. doi: 10.1016/bs.acr.2016.01.007
Weitere Themen
Erstellt: 04.05.2019
Herausgeber: Deutsches Krebsforschungszentrum (DKFZ) │ Autoren/Autorinnen: Internet-Redaktion des Krebsinformationsdienstes. Lesen Sie mehr über die Verantwortlichkeiten in der Redaktion.
Aktualität: Wir prüfen alle Inhalte regelmäßig und passen sie an, wenn sich ein Aktualisierungsbedarf durch Veröffentlichung relevanter Quellen ergibt. Lesen Sie mehr über unsere Arbeitsweise.