- Krebsforschung hat das Ziel, die Diagnostik und Behandlung von Krebs weiterzuentwickeln und neue Möglichkeiten zur Früherkennung und Vorbeugung zu finden.
- Forschung zu Krebs ist sehr aufwändig und verläuft in vielen einzelnen oder ineinandergreifende Stufen. Bis aus Experimenten im Labor ein zugelassenes Arzneimittel oder eine etablierte Diagnosemethode wird, kann es viele Jahre dauern.
- In diesem Text erfahren Sie, wie Krebsforschung abläuft, wer daran beteiligt ist und wie die Sicherheit für Krebspatientinnen und Krebspatienten gewährleistet wird.
Beteiligung von Patientinnen und Patienten an der Krebsforschung
Eine Möglichkeit, Patientinnen und Patienten stärker in die Krebsforschung einzubeziehen, bietet die Plattform www.fragdiepatienten.de des Deutschen Krebsforschungszentrums. Hier können Betroffene ihre Sichtweise in Umfragen einbringen.
Krebsforschung: Überblick
Bild: © science photo, Shutterstock
In der Krebsforschung untersuchen Wissenschaftlerinnen und Wissenschaftler systematisch, wie Krebserkrankungen entstehen, wie man sie erkennen und behandeln kann und wie man ihnen vorbeugen kann. Dafür arbeiten viele Fachdisziplinen in verschiedenen Phasen der Forschung zusammen.
Grundlagenforschung: Sie dient dazu, ganz allgemein das Wissen zu erweitern. In der Krebsforschung gehört beispielsweise dazu, die Unterschiede zwischen gesundem Gewebe und Tumorzellen sowie die grundlegenden Abläufe bei der Entstehung von Krebs zu verstehen. Die dabei gewonnenen Erkenntnisse bilden die Grundlage für alle folgenden Entwicklungen.
Translationale Forschung: Sie hat die Aufgabe, Erkenntnisse aus der Grundlagenforschung weiterzuentwickeln, um sie für den Menschen direkt nutzbar zu machen. So können beispielsweise auf Basis neuer Erkenntnisse zur Tumorbiologie neue Arzneimittel erforscht werden.
Angewandte Forschung: Sie verfolgt praktische Lösungen und verwertet Erkenntnisse häufig auch wirtschaftlich. Durch anwendungsorientierte Forschung entstehen zum Beispiel verbesserte Geräte zur bildgebenden Krebsdiagnostik oder Labortests für den Einsatz in Arztpraxis und Klinik.
Wo wird zu Krebs geforscht?

Bild: © DKFZ; Foto: Tobias Schwerdt
Krebsforschung findet an Universitäten, Universitätskliniken sowie großen Krankenhäusern anderer Träger statt.
Mediziner und Wissenschaftler vieler weiterer Fachrichtungen forschen zudem an außeruniversitären Einrichtungen, vor allem den Instituten der Helmholtz-Gemeinschaft Deutscher Forschungszentren e. V., der Max-Planck-Gesellschaft e. V. oder der Fraunhofer-Gesellschaft zur Förderung der angewandten Forschung e.V..
- Zur Helmholtz-Gemeinschaft gehört auch das Deutsche Krebsforschungszentrum Heidelberg, die größte biomedizinische Forschungseinrichtung in Deutschland.
Bundesinstitutionen betreiben und fördern ebenfalls Forschung zu krebsbezogenen Themen, darunter beispielsweise das Bundesinstitut für Risikobewertung (BfR) oder das Bundesamt für Strahlenschutz (BfS). Beim Robert Koch-Institut ist das Zentrum für Krebsregisterdaten (ZfKD) angesiedelt.
Auch in der Industrie wird intensiv zu Krebs geforscht, vom Großkonzern bis zum mittelständischen und manchmal auch kleinen Unternehmen.
Wie wird Krebsforschung finanziert?
Bund und Länder stellen in Deutschland Mittel bereit, um die Forschung an öffentlichen Einrichtungen zu finanzieren. Geldgeber sind zum Beispiel das Bundesministerium für Forschung, Technologie und Raumfahrt (BMFTR), das Bundesministerium für Gesundheit (BMG) und je nach Forschungsthema weitere Ministerien.
Auch die Europäische Union fördert Forschungsvorhaben.
Die Deutsche Forschungsgemeinschaft (DFG) sowie Stiftungen oder spendenfinanzierte Organisationen wie etwa die Stiftung Deutsche Krebshilfe bieten ebenfalls Förderprogramme an.
Beteiligung der Industrie: Manchmal fördert auch die Industrie, etwa pharmazeutische Unternehmen, bestimmte Forschungsvorhaben. Geht es um die letzten Phasen der Arzneimittelprüfung bevor ein neues Produkt auf den Markt kommt, kommen die Mittel dafür in der Regel vom Hersteller.
Beteiligung von Kostenträgern: Nur in seltenen Ausnahmen sind Krankenversicherungen an der Studienfinanzierung beteiligt. Die Beiträge Versicherter sollen vorrangig ihrer Versorgung mit geprüften Verfahren zugutekommen – dies ist im Sozialgesetzbuch festgelegt. Die Kosten von Forschung und Studien gehören daher nicht zum Leistungsumfang der Krankenkassen.
Epidemiologische Studien: Suche nach Zusammenhängen
Lexikon
Epidemiologie ist die Lehre von der Häufigkeit von Erkrankungen sowie von den Faktoren, die diese Häufigkeit beeinflussen.
In der Krebsforschung steht sie für das Beobachten großer Gruppen von Menschen und ihren Erkrankungsraten, meist über einen langen Zeitraum hinweg.
Eine wichtige Aufgabe der Krebsforschung ist die Suche nach Krebsauslösern sowie nach Möglichkeiten zur Krebsvorbeugung. Eine Methode hierfür ist es, große Bevölkerungsgruppen in sogenannten epidemiologischen Studien zu untersuchen.
Diese Studien sind in der Regel rein beobachtend ("nicht-interventionell"). Das bedeutet: Forschende beschränken sich darauf, Daten zu erheben und auszuwerten. Sie verändern nichts aktiv an einer diagnostischen Maßnahme oder einer Therapie – im Gegensatz zur klinischen Studie.
Studientypen in der Epidemiologie
Lexikon
Bias (englisch): Bezogen auf eine Studie versteht man darunter einen systematischen Fehler. Dieser führt zur Verzerrung von Studienergebnissen: Die Ergebnisse weichen dann systematisch von dem "wahren" Werten ab. Ein Bias kann dazu führen, dass die wahre Wirkung einer Maßnahme oder Exposition über- oder unterschätzt wird.
Zu den wichtigsten Studientypen der Epidemiologie gehören:
Kohortenstudien: Sie vergleichen Gruppen von Menschen ("Kohorten"). Die eine Gruppe ist beispielsweise einem bestimmten Risikofaktor ausgesetzt, bei der anderen Gruppe spielt der Risikofaktor keine Rolle.
- Kohortenstudien lassen sich sowohl in die Zukunft gerichtet ("prospektiv") als auch rückwirkend ("retrospektiv") durchführen.
- Bei rückwirkenden Befragungen kann das Ergebnis durch die lückenhafte Erinnerung der Teilnehmenden oder nicht mehr vorliegende Unterlagen zur Krankengeschichte verzerrt werden ("Bias").
Fall-Kontroll-Studien(Beobachtungsstudien): Solche Studien vergleichen rückblickend Personen, die eine bestimmte Krankheit haben ("Fälle") mit gesunden Personen ("Kontrollen").
- Forschende erfassen in beiden Gruppen alle denkbaren Informationen über Lebensstil, Beruf oder mögliche Risiken in der Vorgeschichte der Teilnehmenden. Waren erkrankte Personen etwa häufiger einem bestimmten Risiko ausgesetzt als nicht Erkrankte, deutet das auf einen Zusammenhang zwischen Krankheit und Risikofaktor hin.
- Wie bei Kohortenstudien können durch wenig zuverlässige Erinnerung der Studienteilnehmer Fehler entstehen ("Bias").
Querschnittsstudien(Prävalenzstudien): Sie erfassen den "Ist-Zustand", etwa den allgemeinen Gesundheitszustand einer bestimmten Bevölkerungsgruppe zu einem bestimmten Zeitpunkt. Mit solchen Erhebungen sind in Deutschland beispielsweise die regionalen bevölkerungsbezogenen Krebsregister beauftragt.
- Mehr dazu im Text Bevölkerungsbezogene und klinische Krebsregister.
Wichtig zu wissen
Beobachtungen in epidemiologischen Studien lassen auf Zusammenhänge schließen, liefern aber keine Beweise.
Ob die beobachteten Zusammenhänge tatsächlich bestehen, müssen Untersuchungen im Labor zeigen. Denn nur dann herrschen Bedingungen, unter denen Forschende Wirkungen unmittelbar auf bestimmte Ursachen zurückführen können.
Laborforschung: Grundlagenforschung, vorklinische Studien
Verwandte Themen
Im Labor untersuchen Krebsforschende wie Krebs entsteht. Also beispielsweise, welche Signale innerhalb der Zelle und zwischen Zellen für Wachstum, Ausbreitung und Überleben von Tumoren verantwortlich sind.
Mit den Ergebnissen können Wissenschaftler Mechanismen verstehen, die bei der Entstehung von Krebs eine Rolle spielen. Sie können sie außerdem nutzen, um neue Diagnose- und Behandlungsverfahren, etwa neue Medikamente, zu entwickeln.
Zellkultur und Tiermodell
Bevor ein neuer Wirkstoff in einer klinischen Studie am Menschen getestet werden kann, müssen Wissenschaftlerinnen und Wissenschaftler im Labor seine grundlegenden Eigenschaften untersuchen.
- Dafür führen sie erste Tests an tierischen oder menschlichen Zellen in sogenannten Zellkulturen – also im "Reagenzglas" – durch.
- Außerdem testen sie neue Wirkstoffe an Tieren, zum Beispiel an Mäusen. Fachleute sprechen dann vom "Tiermodell".
- Vermehrt kommen auch Computermodelle zum Einsatz. Mithilfe mathematischer Simulationen können sie verschiedene krankheitsrelevante Prozesse in menschlichen Zellen, Geweben und Organen vorhersagen.
In diesen vorklinischen (auch "präklinisch" genannten) Studien werden beispielsweise erste Daten zum Wirkmechanismus, zur Giftigkeit (Toxizität) und zur möglichen Dosierung eines späteren Arzneimittels geliefert.
Aus den Ergebnissen im Tiermodell lassen sich Rückschlüsse auf die mögliche Wirkung eines Stoffs im menschlichen Körper ziehen.
Wichtig zu wissen
Die Ergebnisse aus der Grundlagenforschung lassen sich nicht ohne Weiteres auf den menschlichen Körper übertragen. Um Aussagen zur Wirksamkeit und zu den Risiken einer Substanz am Menschen treffen zu können, sind klinische Studien notwendig.
Deutsches Konsortium für Translationale Krebsforschung (DKTK)
Das Deutsche Konsortium für Translationale Krebsforschung (DKTK) ist eines der Deutschen Zentren der Gesundheitsforschung (DZG): Dazu gehören mehr als 20 onkologisch besonders ausgewiesenen Universitätskliniken und akademischen Forschungseinrichtungen an 8 Standorten. Das Deutsche Krebsforschungszentrum (DKFZ) bildet dabei das Kernzentrum des DKTK.
Das Ziel: Erkenntnisse aus der Grundlagenforschung sollen möglichst schnell in neue Ansätze zur Prävention, Diagnostik und Behandlung von Krebserkrankungen übertragen und Strategien für die personalisierte Onkologie entwickelt werden. Mehr Informationen dazu finden Sie auf der DKTK-Website.
Klinische Studien: Definitionen
Nach Abschluss der vorklinischen Untersuchungen im Labor und an Tieren müssen Mediziner, Wissenschaftler und zukünftige Hersteller in klinischen Studien prüfen, ob ein neues Medikament oder Verfahren wirksam, sicher und verträglich ist
Was bedeutet "klinisch"?
"Klinische" Studie bedeutet nicht unbedingt, dass die Studie an einer Klinik stattfindet. Vielmehr sind, im Gegensatz zu Laborstudien, Prüfungen am Menschen gemeint.
Was bedeutet "multizentrisch"?
An klinischen Studien können mehrere Institutionen oder Kliniken beteiligt sein. Das bezeichnen Fachleute als "multizentrisch".
Was ist mit Ein- und Ausschlusskriterien gemeint?
Wer an einer klinischen Studie teilnehmen kann und wer nicht, definieren vorab festgelegte Ein- und Ausschlusskriterien.
Beispiele sind
- Geschlecht,
- Alter,
- Vor- und Begleiterkrankungen,
- Art und Stadium der Krebserkrankung und
- Gesundheitszustand der Teilnehmenden.
Diese Festlegungen sind wichtig, um die Studienbedingungen überschaubar zu halten und ein statistisch belastbares Ergebnis zu erzielen.
Vorteile:
- Patientinnen und Patienten werden passgenau in die Studien eingeschlossen, von denen sie möglicherweise profitieren können
- Dadurch können Prüfärztinnen und -ärzte die Ergebnisse der verschiedenen Studiengruppen besser miteinander vergleichen. Dadurch wird die Studie aussagekräftiger.
- Patientinnen oder Patienten tragen kein unnötiges Risiko unnötigerweise durch eine experimentelle Behandlung, die für sie möglicherweise nicht geeignet sind.
Nachteile:
- Eine Studie bildet nicht immer die medizinische Wirklichkeit ab: Ob Patientinnen oder Patienten, die die Einschlusskriterien nicht erfüllen, später einmal genauso auf die geprüfte Therapie reagieren, ist nicht sicher.
- Spezielle Personengruppen wie Kinder oder Schwangere sind in klinischen Studien zur Erprobung neuer Arzneimittel äußerst selten vertreten. Hier spielen vor allem ethische Gründe eine Rolle.
Was bedeutet "randomisiert", "kontrolliert", "doppelblind"?
Gut zu wissen
Placebo-kontrollierte Studien sind in der Krebsforschung eher selten: Eine Placebo-Verabreichung, also eine Nicht-Behandlung, wäre angesichts der Schwere der Erkrankung ethisch oft nicht zu vertreten.
Zu den wichtigsten Studientypen gehören "randomisierte kontrollierte" Studien (englisch: Randomized Controlled Trial, RCT). Diese können "offen", "blind" oder "doppelblind" durchgeführt werden:
- "Randomisiert": Die Studienteilnehmenden werden per Zufallsverfahren auf die einzelnen Gruppen oder "Studienarme" verteilt.
- "Kontrolliert": Eine Teilnehmendengruppe erhält die neue Methode und eine Kontrollgruppe die bisher bewährte Behandlung oder ein Scheinmedikament ohne Wirkstoff ("Placebo").
- "Offen": Der oder die Studienteilnehmende weiß nach der Verteilung, zu welcher Behandlungsgruppe er oder sie gehört.
- "Verblindet": Der oder die Studienteilnehmende weiß nach der Verteilung nicht, zu welcher Behandlungsgruppe er oder sie gehört.
- "Doppelblind": Weder Ärzte noch Teilnehmende wissen, wer die neue Substanz und wer die Kontrollbehandlung erhält.
Studien, bei denen es keine Kontrollgruppe gibt oder deren Studienteilnehmer nicht nach dem Zufallsprinzip aufgeteilt wurden, sind in der Regel weniger verlässlich als randomisierte, kontrollierte und verblindete Studien.
Neue Therapieansätze: Neuartige Studienarten
In der personalisierten Medizin richtet sich die Behandlung nicht nur nach der Krebsart, sondern auch nach den individuellen molekulargenetischen Eigenschaften (Biomarker) im Tumor.
Da manche dieser Biomarker sehr selten sind, sind klassische randomisierte kontrollierte Studien oft nicht durchführbar. Grund: Es gibt zu wenige Erkrankte für diese Art der klinischen Studie.
Daher wurden neue Studienformen entwickelt, bei denen Medikamente über verschiedene Krebsarten hinweg getestet werden – die sogenannten
- "Basket-Studien" (deutsch: "Korb-Studien") oder
- "Umbrella-Studien" (deutsch: "Regenschirm-Studien").
Voraussetzung für die Teilnahme ist, dass der jeweilige Biomarker im Tumor nachgewiesen wurde.
Was sind "Endpunkte" einer Studie?
Voraussetzung für eine Arzneimittel-Zulassung
Der Nutzen eines Medikaments muss die Risiken deutlich übersteigen.
Was in einer Studie genau geprüft wird und wie erfolgreich die neue Behandlung war, geben die sogenannten "Endpunkte" an.
Wichtige Endpunkte betreffen
- die Wirksamkeit,
- Verträglichkeit und
- Sicherheit der Behandlung.
Solche sogenannten "harten" Endpunkte sind gut messbar und klar definiert. Sie sind oft die Voraussetzung für die Zulassung eines Medikaments. Beispiele für "harte" Endpunkte:
- "Gesamtüberleben" (englisch: overall survival, OS): Anteil der Patientinnen und Patienten, die zu einem definierten Zeitpunkt ohne oder mit Krankheitszeichen am Leben sind.
- "Remission": Der komplette, wenn auch oft vorübergehende Rückgang von Krankheitszeichen.
- "Progressionsfreies Überleben" (englisch: progression free survival, PFS): Der Zeitraum, über den sich durch das neue Verfahren das Fortschreiten der Krankheit aufhalten lässt.
Andere Endpunkte wie Lebensqualität oder Schmerzen sind schwerer zu messen. Mit ihnen können Fachleute die Behandlung zusätzlich beurteilen. Gerade für Krebspatientinnen und -patienten sind diese Endpunkte ebenfalls wichtige Parameter, um den Nutzen einer Behandlung zu beurteilen.
Phasen der Klinischen Prüfung
Klinische Studien folgen der vorklinischen Studienphase im Labor. Sie unterliegen strengen Richtlinien und werden sorgfältig überwacht. Sie erfolgen international weitgehend standardisiert in mehreren aufeinander folgenden Phasen.
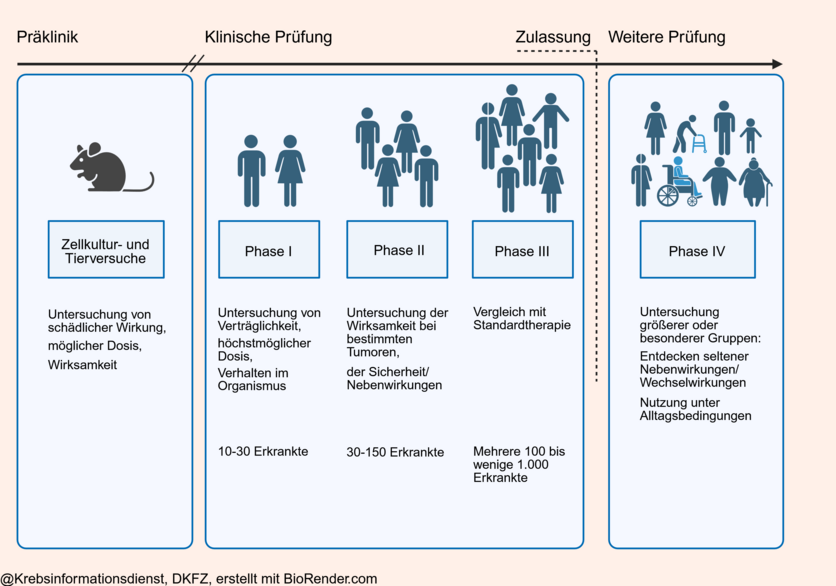
Bild: © Krebsinformationsdienst, DKFZ; erstellt mit Biorender.com
Phase I: Erste Anwendung am Menschen
Unter kontrollierten Bedingungen testen Forschende die Wirkung einer neuen Substanz oder einer neuen Methode auf eine kleine Gruppe von Studienteilnehmenden.
- Ziel ist es, die Sicherheit und Verträglichkeit einer praktischen Anwendung oder eines Wirkstoffs zu beurteilen.
- An Phase-I-Studien nehmen normalerweise nur gesunde Freiwillige teil. In der Krebsmedizin ist dies allerdings meist nicht möglich. Denn die meisten Krebstherapien bergen das Risiko von Nebenwirkungen oder Spätfolgen. Aus diesem Grund erhalten in der Regel nur Patienten und Patientinnen Krebstherapien, nicht aber gesunde Personen.
- Phase-I-Studien werden meist stationär mit etwa 10 bis 30 Teilnehmenden durchgeführt.
Phase II: Therapeutische Prüfung, Dosisfindung
Mit klinischen Studien der Phase II verfolgen Forschende verschiedene Ziele:
- Belegen, dass das Präparat eine therapeutische Wirkung hat. Zum Beispiel, dass durch das Medikament ein Tumor langsamer wächst.
- Die geeignete Dosierung eines Präparates bestimmen. Die Dosierung muss hoch genug sein, um eine Wirksamkeit zu erzielen. Gleichzeitig muss sie so gering wie möglich sein, damit die Behandlung möglichst wenige Nebenwirkungen hat.
- An Phase-II-Studien nehmen etwa 30 bis 150 Patientinnen und/oder Patienten teil.
Phase III: Therapeutische Bestätigung (Wirksamkeitsnachweis)
Groß angelegten Studien der Phase III können die Wirksamkeit und Sicherheit einer neuen Substanz beziehungsweise eines neuen Verfahrens für eine bestimmte Anwendung (Indikation) bestätigen.
- Phase-III-Studien sollen auch zeigen, ob Medikamente oder Methoden praxistauglich sind und wie sie im Vergleich mit einer Standardbehandlung abschneiden.
- Sie sind Voraussetzung für die Zulassung eines neuen Arzneimittels.
- Meist sind sie randomisiert-kontrolliert und multizentrisch.
- An den Studien nehmen mehrere 100 Patientinnen und/oder Patienten teil, meist jedoch noch deutlich mehr.
Phase IV: Therapeutische Anwendung
Phase-IV-Studien werden mit bereits zugelassenen Arzneimitteln durchgeführt. Sie können zum Beispiel seltene Nebenwirkungen oder Wechselwirkungen mit anderen, gleichzeitig eingenommenen Medikamenten aufspüren.
- In Phase-IV-Studien wird der Probandenkreis nochmals erweitert: Manche Nebenwirkungen zeigen sich unter Umständen erst unter Alltagsbedingungen, wenn sehr viele sehr unterschiedliche Patienten behandelt werden, darunter auch ältere Menschen oder Patienten mit Begleiterkrankungen.
- Die Studien sind begrenzt auf das zugelassene Anwendungsgebiet sowie die zugelassene Dosierung und Verabreichungsform des Arzneimittels.
Therapieoptimierungsstudien
Sogenannte Therapieoptimierungsstudien (TOS) dienen dazu, bereits bewährte onkologische Behandlungen zu verbessern.
- Diese Studien sind immer randomisiert, aber meist nicht placebokontrolliert und verblindet.
- Ziel der Untersuchung kann sein, eine Behandlung zukünftig besser der individuellen Situation von Patientinnen und Patienten anzupassen oder bereits zugelassene Arzneimittel in neuen Kombinationen oder Dosierungen zu prüfen. Auch können mehrere bewährte Therapiearten neu kombiniert werden, beispielsweise Operation, Bestrahlung und/oder Medikamente in bestimmter zeitlicher Abfolge.
Klinische Studien: Erfassen der Sicherheit
Klinische Studien dienen nicht nur dazu, die Wirksamkeit von Arzneimitteln zu prüfen. Auch unbeabsichtigte Wirkungen müssen Prüfärztinnen und Prüfärzte untersuchen. Besonders wichtig ist es dabei, herauszufinden, ob eine gesundheitliche Beeinträchtigung der Studienteilnehmenden auf das getestete Medikament zurückzuführen ist oder zufällig auftritt.
- Zeitlicher Zusammenhang: Gesundheitliche Beschwerden der Studienteilnehmenden, die in zeitlichem Zusammenhang mit der Behandlung auftreten, gelten zunächst als "unerwünschte Ereignisse" (englisch: "adverse events"). Dabei ist es unerheblich und oft auch noch gar nicht klar, ob sie durch das getestete Präparat hervorgerufen wurden oder nur zufällig während der Testphase aufgetreten sind.
- Ursächlicher Zusammenhang: "Nebenwirkungen" im eigentlichen Sinn sind dagegen nur Reaktionen, die wahrscheinlich oder sicher durch die Einnahme des geprüften Medikaments entstehen. Wichtig ist, dass im Verlauf der Studie eindeutig festgestellt werden kann, ob die unbeabsichtigte Wirkung tatsächlich vom Medikament kommt. Im Englischen werden Nebenwirkungen als "adverse (drug) reaction" bezeichnet, im Deutschen ist auch die Bezeichnung "unerwünschte Arzneimittelwirkung” (UAW) üblich.
"Schwerwiegende" Nebenwirkungen und Ereignisse
Manchmal können Nebenwirkungen oder "unerwünschte Ereignisse" während einer Studie schwerwiegend sein – zum Beispiel, wenn sie lebensbedrohlich sind oder eine Krankenhausbehandlung nötig machen.
Dann müssen die Studienärztinnen und -ärzte das sofort an den Hersteller des Prüfmedikaments melden.
Besteht der Verdacht, dass das Medikament die Ursache ist und diese Reaktion nicht vorhersehbar war, werden zusätzlich die Ethikkommission und die zuständige Behörde informiert. So wird sichergestellt, dass die Sicherheit der Teilnehmenden nicht weiter gefährdet wird.
Gesetzliche Vorgaben: Schutz der Patienten
Klinische Prüfungen von Arzneimitteln und Medizinprodukten unterliegen in Deutschland unter anderem dem Arzneimittelgesetz (AMG) und dem Gesetz über Medizinprodukte (MPG). Darin ist unter anderem geregelt, wie die Prüfungen ablaufen und wie die Teilnehmenden geschützt werden müssen.
Zuständige Behörden:
- Klinische Prüfungen neuer Arzneimittel und Medizinprodukte müssen durch das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) genehmigt werden.
- Für Impfstoffe, Blutprodukte, Knochenmarkzubereitungen, Gentransfer-Arzneimittel, Zelltherapeutika und gentechnisch hergestellte Blutbestandteile ist das Paul-Ehrlich-Institut (PEI) zuständig.
- Die Europäische Arzneimittelagentur (EMA, European Medicines Agency) kommt erst ins Spiel, wenn die klinische Prüfphase abgeschlossen ist und es um die Zulassung von Krebsmedikamenten geht. Diese werden nicht national, sondern innerhalb der EU von der Europäischen Kommission für alle Länder zugelassen.
Ethikkommission: Zustimmung nötig
Lexikon
Ethikkommission: Ist eine Gruppe von Fachleuten, die überprüft, ob Forschungsprojekte oder Studien an Menschen ethisch vertretbar sind. Sie setzt sich aus Expertinnen und Experten aus Medizin, Recht, Theologie und anderen Wissenschaften sowie Patienten zusammen.
- Die Kommission soll sicherstellen, dass die Teilnehmenden bestmöglich vor möglichen negativen Folgen geschützt sind.
- Dazu prüft sie rechtliche, medizinische und soziale Aspekte des Vorhabens.
- Anschließend gibt die Ethikkommission ein Votum ab, ob das Forschungsprojekt durchgeführt werden darf. Ohne ein positives Votum darf das Projekt nicht durchgeführt werden.
Ohne Zustimmung einer Ethikkommission ist in Deutschland keine klinische Forschung am Menschen möglich.
Die regional zuständige Ethikkommission prüft,
- ob eine Studie juristisch vertretbar ist und
- ob der Studienbetreiber gewährleisten kann, dass er den Teilnehmenden nicht schadet.
Auch ethische und soziale Gesichtspunkte spielen eine Rolle.
Zu jeder medizinischen Fakultät und Landesärztekammer gehört heute eine eigene Ethikkommission. Sie setzt sich aus Medizinern und Juristen zusammen, aber auch Theologen oder Sozialwissenschaftler sind vertreten.
Zum Wohl der Patienten: Helsinki-Deklaration und "Gute klinische Praxis"
Helsinki-Deklaration: Nationale und internationale Ärzteorganisationen verpflichten sich, bei der Forschung stets das Wohl, die Sicherheit und die Würde der Patientinnen und Patienten zu wahren. Ethische Aspekte der Forschung an Menschen sind seit 1964 in der sogenannten Helsinki-Deklaration der World Medical Association (WMA) berücksichtigt (Hinweis: Link geht auf englischsprachigen Text).
"Gute klinische Praxis" (englisch "Good Clinical Practice", GCP): Die international anerkannten GCP-Standards legen fest, wie Studien ethisch und wissenschaftlich korrekt geplant, durchgeführt und ausgewertet werden. Sie sichern den Schutz der Teilnehmenden sowie die Qualität und Vergleichbarkeit der Studienergebnisse.
Nach den klinischen Studien: So geht es weiter
Forschende müssen Studiendaten sorgfältig dokumentieren und statistisch auswerten. Üblicherweise prüfen unabhängige Expertinnen und Experten zusätzlich die Ergebnisse.
Veröffentlichung von Studienergebnissen: Wissen bewerten
Zum Weiterlesen
Studienergebnisse werden in der Regel von den durchführenden Wissenschaftlern in Fachzeitschriften veröffentlicht und auf Kongressen zur Diskussion gestellt. Vor der Publikation in Fachzeitschriften begutachten zunächst Experten in einem sogenannten "Peer-Review-Verfahren" die eingereichten Arbeiten. Dieses Verfahren dient der Qualitätssicherung wissenschaftlicher Publikationen.
Arzneimittel-Zulassung und Etablierung als Standard
Eine neue Therapie wird nur zugelassen, wenn ihr Nutzen die Risiken überwiegt. Bei Krebsmedikamenten gilt nicht nur die Heilung oder eine längere rückfallfreie Zeit als Vorteil – auch eine einfachere Anwendung, etwa Tabletten statt Infusionen, kann ein Nutzen sein.
Nach erfolgreicher klinischer Prüfung reichen Hersteller die Studienergebnisse bei den zuständigen Behörden ein, um die Zulassung für ihr Arzneimittel zu erhalten.
- Für Krebsmedikamente ist die Europäische Arzneimittelagentur (EMA) verantwortlich.
- Andere Medikamente werden in Deutschland beim Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) oder beim Paul-Ehrlich-Institut (PEI) zugelassen.
Bis eine neue Behandlungsmethode zum anerkannten Standard in der Krebsmedizin wird, vergehen oft viel Jahre. Leitlinien fassen stets den aktuellen Behandlungsstandard zusammen – sie werden von medizinischen Fachgesellschaften erstellt. Eine Übersicht bietet die Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF).
Arzneimittelfrühbewertung: Das AMNOG
Kurz nach der Markteinführung eines neuen Arzneimittels prüft der Gemeinsame Bundesausschuss (G-BA), ob das Medikament einen Zusatznutzen gegenüber bisherigen Therapien bietet. Diese Bewertung ist im Gesetz zur Neuordnung des Arzneimittelmarktes (AMNOG) festgelegt. Basis ist eine frühe Nutzenbewertung des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG), das vom G-BA beauftragt wird.
Das Ergebnis des G-BA zur Nutzenbewertung bildet die Grundlage für die Preisfestsetzung des Arzneimittels. Eine Übersicht aller geprüften Medikamente mit neuen Wirkstoffen findet sich auf der Website des G-BA.
Das IQWiG stellt die frühen Nutzenbewertungen verständlich aufbereitet unter gesundheitsinformation.de bereit.
Meldepflicht bei Nebenwirkungen
Nebenwirkungen melden
Patientinnen und Patienten können den deutschen Arzneimittelbehörden online auch selbst Arzneimittel-Nebenwirkungen melden.
Wie sicher ein Arzneimittel ist, können die Expertinnen und Experten in den Arzneimittelbehörden zum Zeitpunkt der Zulassung nicht abschließend beurteilen.
Studienbedingungen entsprechen nicht der Wirklichkeit:
- Ein Arzneimittel wird an einer vergleichsweise geringen Zahl von Patientinnen und Patienten erprobt.
- Die Teilnehmenden wurden anhand der Ein- und Ausschlusskriterien klinischer Studien ausgewählt: Sie entsprechen in der Regel nicht den "Durchschnittspatienten" in Arztpraxen oder Kliniken.
- Seltene oder sehr seltene unerwünschte Wirkungen, Wechselwirkungen oder andere Risiken im Zusammenhang mit der Arzneimittelanwendung können Forscher in klinischen Studien oft nicht erkennen.
Treten nach der Zulassung unerwartet Neben- oder Wechselwirkungen auf, müssen die Arzneimittelbehörden informiert werden: Entweder durch die behandelnden Ärzte oder Apothekerinnen und Apotheker oder durch die Betroffenen selbst.
In den Arzneimittelbehörden arbeiten Fachleute, die auf Basis dieser Meldungen die Risiken kontinuierlich bewerten und Fachkreise sowie die Öffentlichkeit entsprechend informieren. Diese Form der Arzneimittelüberwachung wird als „Pharmakovigilanz” bezeichnet.
Ausnahmen: Marktzugang ohne klinische Studien
Medizinprodukte müssen nicht wie Arzneimittel zugelassen, sondern nur registriert werden. Dafür muss der Hersteller nachweisen, dass sein Produkt sicher und leistungsfähig ist. Klinische Prüfungen von Medizinprodukten sind nur in bestimmten Fällen notwendig. Beispielsweise dann, wenn es bisher kein vergleichbares Produkt auf dem Markt gibt.
- Weitere Informationen bietet das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM)
Pflanzliche, homöopathische und anthroposophische Arzneimittel haben in Deutschland einen Sonderstatus. Besondere Regelungen im Arzneimittelgesetz erlauben es, diese Medikamente auch ohne wissenschaftliche Prüfung der Wirkung und der Nebenwirkungen zuzulassen. Damit Patienten solche Mittel in Deutschland erhalten dürfen, genügt ein Eintrag im Register der Arzneimittelbehörde. Solche Medikamente gehören zu den sogenannten "besonderen Therapierichtungen".
- Weitere Informationen bietet das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM)
Auch sogenannte "traditionelle Arzneimittel" sind ohne klinische Prüfung auf dem Markt. Für ihre Registrierung muss der Hersteller nachweisen, dass das Arzneimittel bereits seit mindestens 30 Jahren traditionell angewendet wird. Viele Baldrianpräparate sind beispielsweise auf diese Weise registriert.
Nahrungsergänzungsmittel sind keine Arzneimittel. Beispielsweise sind fast alle Vitaminpräparate "Lebensmittel", auch dann, wenn man sie in der Apotheke kaufen kann. Sie unterliegen keiner Zulassungspflicht, müssen aber beim Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL) registriert werden. Eine therapeutische Wirkung dürfen sie nicht haben. Auch dürfen Hersteller sie nicht mit einer angeblichen Heilwirkung bewerben.
- Weitere Informationen finden Sie auf der Website des BVL.
Auch kosmetische Mittel sind nicht zulassungspflichtig. Bei manchen Produkten ist nicht immer auf den ersten Blick zu erkennen, ob es sich um ein Arzneimittel oder ein kosmetisches Mittel handelt. Beispiele sind etwa Salben oder Badezusätze. Sind es Kosmetika, dürfen sie nicht mit einer Heilwirkung beworben werden. Die Hersteller müssen jedoch garantieren, dass ihre Produkte unbedenklich sind. Nur bestimmte Inhalts- und Zusatzstoffe sind laut Kosmetikverordnung zulassungspflichtig, darunter Konservierungsstoffe, Farbstoffe oder UV-Filter.
- Weitere Informationen finden sich auf den Internetseiten des Bundesinstitutes für Risikobewertung (BfR) unter "Produkte".
Quellen und Links für Interessierte und Fachkreise
Im Folgenden finden Sie eine Auswahl an hilfreichen Links zum Weiterlesen und Quellen, die für die Erstellung dieses Textes genutzt wurden.
Quellen und weiterführende Informationen
Gesetze und Verordnungen
Unter www.gesetze-im-internet.de sind unter anderem folgende Gesetze und Verordnungen abrufbar:
- Gesetz über den Verkehr mit Arzneimitteln (Arzneimittelgesetz, AMG),
- Verordnung über die Anwendung der Guten klinischen Praxis bei der Durchführung von klinischen Prüfungen mit Arzneimitteln zur Anwendung am Menschen (GCP-Verordnung, GCP-V),
- Gesetz über Medizinprodukte (Medizinproduktegesetz, MPG),
Europäische Richt- und Leitlinien können unter https://eur-lex.europa.eu abgerufen werden, zum Beispiel unter Eingabe der Dokumentnummer unter "Einfache Suche".
Deutsche und internationale Behörden und Einrichtungen
- Bundesministerium für Forschung, Technologie und Raumfahrt (BMFTR) https://www.bmftr.bund.de
- Bundesministerium für Gesundheit (BMG): www.bundesgesundheitsministerium.de
- Deutsche Forschungsgemeinschaft (DFG): www.dfg.de
- Gemeinsamer Bundesausschuss (G-BA): www.g-ba.de
- Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM): www.bfarm.de
- Paul-Ehrlich-Institut (PEI): www.pei.de
- Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG), www.iqwig.de
- Europäische Arzneimittelagentur, European Medicines Agency (EMA): www.ema.europa.eu
- Europäische Kommission, European Commission, Pharmaceutical Legislation (EudraLex):https://health.ec.europa.eu/medicinal-products/eudralex_en
- Die U.S.-amerikanische Arzneimittelbehöre, U.S. Food and Drug Administration (FDA), informiert in englischer Sprache unter www.fda.gov.
Zentren für vorklinische Forschung
Grundlagenforschung zu Krebs findet an Universitäten statt, an Universitätskliniken und auch großen Krankenhäusern anderer Träger. Mediziner und Wissenschaftler vieler weiterer Fachrichtungen forschen zudem an außeruniversitären Einrichtungen, darunter:
- Institute der Helmholtz-Gemeinschaft (www.helmholtz.de). Zur Helmholtz-Gemeinschaft gehört auch das Deutsche Krebsforschungszentrum Heidelberg (DKFZ, www.dkfz.de), die größte biomedizinische Forschungseinrichtung in Deutschland.
- Institute der Max-Planck-Gesellschaft (www.mpg.de)
- Institute der Fraunhofer-Gesellschaft (www.fraunhofer.de)
- Institute der Leibniz-Gemeinschaft (www.leibniz-gemeinschaft.de)
Fachliteratur
- Fachpublikationen bieten weiterführende Informationen zum Thema.
- Diese liegen überwiegend in englischer Sprache vor, sie richten sich an vorinformierte Leser.
- Wie man am besten nach Fachliteratur sucht ist in unserem Informationsblatt "Suche nach medizinischer Fachliteratur" (PDF) zusammengefasst.
Studiensuche
- Einen Überblick über laufende Studien bei onkologischen Erkrankungen bieten diverse Studienregister. Allerdings kann zurzeit kein Register Anspruch auf Vollständigkeit erheben.
- Eine generelle Meldepflicht für alle Arten klinischer Studien besteht in Deutschland nicht.
- Ärzte sowie andere Fachleute finden Links für einen ersten Einstieg in die Suche nach klinischen Studien im Abschnitt Studiensuche des Ressourcen-Centers für Fachkreise von krebsinformationsdienst.med.