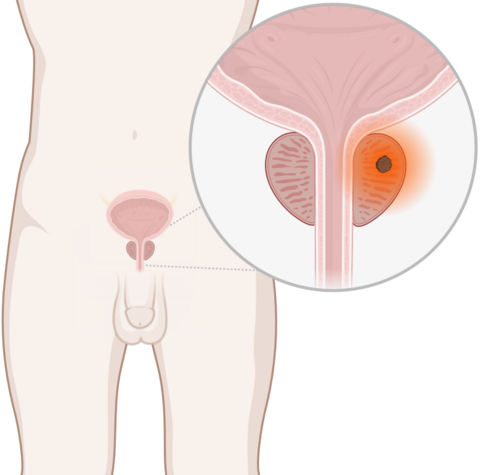
- Eine Bestrahlung kann Prostatakrebs heilen. Hat ein Mann bereits Tumorabsiedlungen (Metastasen), kann eine Bestrahlung Beschwerden lindern.
- Es gibt verschiedene Verfahren, um Prostatakrebs zu bestrahlen: die perkutane Bestrahlung, eine Brachytherapie oder nuklearmedizinische Therapien.
- Eine Strahlentherapie kann vorübergehende Nebenwirkungen haben, aber auch langfristige Beschwerden verursachen.
Wichtig: Informationen aus dem Internet können Ihnen einen Überblick bieten. Sie sind aber nicht dazu geeignet, die Beratung durch einen Arzt oder eine Ärztin zu ersetzen.
Strahlentherapie bei Prostatakrebs: Wichtiges in Kürze
Eine Strahlentherapie wirkt lokal auf den Prostatatumor. So kann gesundes Gewebe um den Prostatakrebs geschont werden. Je nach Tumorstadium können zusätzliche Behandlungen zu einer Bestrahlung notwendig sein.
Die Heilungschance nach einer Bestrahlung hängt vom Tumorstadium ab. Bei Prostatakrebs im frühen Stadium lässt sich in der Regel eine Heilung erreichen. Hat ein Tumor schon Absiedlungen (Metastasen) gebildet, kann eine Strahlentherapie dabei helfen, Beschwerden zu lindern.
Es gibt verschiedene Bestrahlungsarten:
Perkutane Strahlentherapie
Brachytherapie
Nuklearmedizinische Therapie
Lexikon
PSA: Abkürzung für "Prostata-spezifisches Antigen". Ein Eiweiß, das von gesunden Prostatazellen, aber vermehrt von Prostatakrebszellen gebildet wird.
Nadir: Der niedrigste gemessene Wert des Prostataspezifischen Antigens (PSA) im Blut nach der Behandlung eines Prostatakarzinoms. Dieser Wert ist von Patient zu Patient verschieden.
Therapieerfolg lässt sich kontrollieren: Der sogenannte PSA-Wert liefert Hinweise, ob die Strahlentherapie bei einem Mann mit Prostatakrebs erfolgreich verlaufen ist. Nach der Behandlung sollte dieser Wert im Blut eines Mannes sinken. Das kann manchmal mehrere Monate dauern. Auch nach einer erfolgreichen Bestrahlung kann der PSA-Wert noch immer in einem messbaren Bereich bleiben (0,0 bis < 0,2 Nanogramm pro Milliliter) – anders als zum Beispiel bei der operativen Entfernung der Prostata (radikale Prostatektomie).
PSA-Wert
Ist der PSA-Wert im Blut erhöht oder steigt er auffällig schnell an? Dann kann das bei einem Mann auf Prostatakrebs hinweisen.
Sinkt der PSA-Wert nach einer Therapie, ist dies in der Regel ein Hinweis, dass die Behandlung erfolgreich war.
- Ab wann der PSA-Wert auffällig ist und warum ein erhöhter PSA-Wert nicht immer zwingend Prostatakrebs als Ursache haben muss, lesen Sie unter Diagnose Prostatakrebs: Untersuchungen bei Krebsverdacht im Abschnitt "Bluttest: PSA-Wert messen".
Mit einer Strahlentherapie sind Nebenwirkungen verbunden. Es gibt Beschwerden, die mit dem Ende der Bestrahlung abklingen. Manchmal kann eine Strahlentherapie aber auch langfristige Folgen haben.
Der PSA-Wert steigt nach der Bestrahlung wieder: Was bedeutet das?
Bild: © Sherry Yates Young, Shutterstock
Steigt der Wert des prostataspezifischen Antigens (PSA) nach einer Bestrahlung im Blut an, kann das auf einen Krankheitsrückfall (Rezidiv) hindeuten. Aber nicht in jeder Situation kehrt die Erkrankung tatsächlich zurück. Fachleute sprechen dann vom sogenannten "Bounce-Phänomen".
PSA-Rezidiv: Steigt der PSA-Wert nach einer Bestrahlung an, kann das durch einen Krankheitsrückfall (Rezidiv) bedingt sein. Von einem "PSA-Rezidiv" oder einem "biochemischen Rezidiv" sprechen Fachleute, wenn der PSA-Wert nach 2 Messungen über 2 Nanogramm pro Milliliter (ng/ml) über dem tiefsten Wert nach der Bestrahlung liegt.
Bounce-Phänomen: Bei etwa 15 bis 30 von 100 Männern mit Prostatakrebs steigt der PSA-Wert 12 bis 24 Monate nach der Strahlentherapie vorübergehend an und fällt danach wieder kontinuierlich ab.
Zum Weiterlesen
Mehr zum PSA-Rezidiv und dem weiteren Vorgehen lesen Sie in unserem Informationsblatt "Prostatakarzinom: PSA-Wiederanstieg nach Strahlentherapie" (PDF).
Zweittumor nach Bestrahlung: Wie hoch ist das Risiko?
Eine Strahlentherapie bei Prostatakrebs kann laut Studien das Risiko für Patienten erhöhen, innerhalb der folgenden 5 bis 10 Jahre an einem zweiten Tumor zu erkranken – etwa an Blasenkrebs oder Darmkrebs. Statistisch gesehen sind unter 100 bestrahlten Patienten etwa 1 bis 2 Männer mehr von einem Zweittumor betroffen als unter 100 Patienten mit Prostatakrebs, die keine Strahlentherapie erhalten haben.
Das Risiko für einen Zweittumor ist zudem von der angewandten Bestrahlungstechnik abhängig. Moderne Bestrahlungstechniken wie etwa eine Brachytherapie oder eine intensitätsmodulierte Radiotherapie (IMRT) erhöhen das Risiko für einen Zweittumor laut Studien wahrscheinlich nicht.

Bild: © Krebsinformationsdienst, DKFZ; erstellt mit BioRender.com
Wann kommt eine Bestrahlung bei Prostatakrebs infrage?
Bei Prostatakrebs ist eine Bestrahlung in unterschiedlichen Krankheitsstadien möglich. Aber nicht in jedem Stadium lässt sich mithilfe einer Strahlentherapie auch eine Heilung erzielen.
Lokal begrenzter Prostatakrebs: Ist der Tumor klein und auf die Prostata begrenzt, kann eine Strahlentherapie die Erkrankung dauerhaft heilen. In diesem Erkrankungsstadium erzielt eine Strahlentherapie eine vergleichbare Wirkung wie eine Operation.
Lokal fortgeschrittener Prostatakrebs:
- Ist der Tumor größer und nicht mehr auf die Prostata begrenzt, kann eine Bestrahlung ebenfalls eine Heilung ermöglichen. In dieser Situation erhalten Männer in der Regel zusätzlich eine Hormonentzugstherapie.
- Eine weitere Möglichkeit ist eine sogenannte adjuvante Strahlentherapie: Dabei wird Männern der Tumor zuerst in einer Operation entfernt. Danach erhalten sie – beginnend innerhalb von 4 bis 6 Monaten – eine Strahlentherapie. Die Strahlentherapie beginnt, wenn der PSA-Wert im Blut möglichst niedrig ist.
Metastasen bei Prostatakrebs
Bei metastasiertem Prostatakrebs haben Männer am häufigsten Metastasen in den Knochen. Metastasen können aber auch in der Leber oder Lunge auftreten.
Mehr zu Lebermetastasen und Knochenmetasen lesen Sie unter Metastasen bei Krebs.
Fortgeschrittener Prostatakrebs mit Metastasen:
- Hat sich der Tumor an mehreren Stellen im Körper ausgebreitet und Tumorabsiedlungen (Metastasen) gebildet? Dann ist durch eine Strahlentherapie keine Heilung mehr möglich. In dieser Situation kann eine Bestrahlung der Knochenmetastasen aber helfen, Beschwerden zu lindern.
- Hat ein Mann bei der Erstdiagnose nur einzelne Knochenmetastasen, kann eine Bestrahlung der Prostata zusätzlich zur Hormonentzugstherapie das Überleben verlängern.
Hoher PSA-Wert nach radikaler Prostatektomie: Steigt der PSA-Wert nach einer operativen Entfernung der Prostata an oder sinkt er nicht ab, erhalten Männer oftmals eine zusätzliche Strahlentherapie. Der Fachbegriff dafür lautet "Salvage-Strahlentherapie" (englisch "salvage" = Rettung). Ziel ist es, noch verbliebene Tumorzellen möglichst vollständig zu zerstören.
Perkutane Strahlentherapie: Von außen über die Haut
Lexikon
Hochenergetische Strahlung stört lebenswichtige Funktionen von Zellen. Dadurch können sie nicht mehr wachsen und sterben ab.
Bestrahlungsfelder sind festgelegte Bereiche des Körpers in einer bestimmten Größe, auf die während einer Strahlentherapie die Strahlung treffen soll.
Bei der perkutanen Bestrahlung befindet sich die Strahlenquelle in größerem Abstand zum Patienten. Ein spezielles Gerät erzeugt die für die Bestrahlung notwendige hochenergetische Strahlung. Diese Strahlung wirkt von außen durch die Haut auf den Prostatakrebs.
Neben den Krebszellen sterben bei der perkutanen Bestrahlung auch gesunde Zellen, die im Bestrahlungsbereich liegen. Vor der eigentlichen Behandlung findet daher in der Regel eine Computertomographie (CT) statt, um die Lage des Tumors zu bestimmen. Mit einem Computer ermitteln Ärzte anschließend das notwendige Bestrahlungsfeld und berechnen die benötigte Strahlendosis. Dadurch wird umliegendes gesundes Gewebe weitgehend geschont.
Fachleute empfehlen folgende Bestrahlungstechniken:
- Bildgeführte Strahlentherapie (IGRT) – sie ermöglicht eine Bestrahlung mit gleichzeitiger Bildgebung. Dadurch lässt sich die Position des Patienten während der Bestrahlung anpassen, beispielsweise, wenn sich der Tumor verschiebt. Abhängig vom bildgebenden Verfahren erhöht sich dabei aber möglicherweise die Strahlenbelastung.
- Intensitätsmodulierte Radiotherapie (IMRT) – diese Technik ist in der Planung und Durchführung sehr aufwendig, weil verschiedene Bereiche unterschiedlich stark bestrahlt werden. Dadurch lässt sich der Tumor aber zielgenauer und intensiver bestrahlen, während gesundes Gewebe geschont wird. Sie kommt daher infrage, wenn der Prostatakrebs in der Nähe eines strahlenempfindlichen Organs wie dem Mastdarm liegt.
Bin ich nach der Bestrahlung radioaktiv? Nein. Nach der perkutanen Bestrahlung sind keine Vorsichtsmaßnahmen nötig.
Zum Weiterlesen
Wie genau eine CT funktioniert, können Sie unter Computertomographie (CT) nachlesen.
Was lässt sich mit der perkutanen Bestrahlung erreichen?
Therapie mit Ziel der Heilung: Mit einer perkutanen Strahlentherapie lässt sich Prostatakrebs bei lokal begrenztem und lokal fortgeschrittenem Prostatakrebs heilen. Manchmal ist eine ergänzende (adjuvante) Hormonentzugstherapie über mindestens 24 bis 36 Monate nötig. Es gibt auch Patienten, die nur über 4 bis 6 Monate eine Hormonentzugstherapie erhalten. Das hängt davon ab, wie fortgeschritten die Erkrankung und wie hoch das Risiko für einen Krankheitsrückfall ist.
Palliative Therapie: Hat sich der Prostatakrebs im Körper ausgebreitet und Metastasen gebildet, lässt sich der Krebs in der Regel nicht mehr heilen. In dieser Situation kann eine Bestrahlung der Metastasen Beschwerden wie Knochenschmerzen lindern. Hat ein Mann bei Erstdiagnose nur wenige Metastasen, kann eine zusätzliche perkutane Bestrahlung der Prostata die Überlebenszeit verlängern.
So läuft die perkutane Bestrahlung ab
Bild: © VILevi, Thinkstockphotos.de
Während der Behandlung liegt der Patient auf einem Untersuchungstisch unter dem sogenannten Linearbeschleuniger. Das ist ein Gerät, das die Strahlung erzeugt. Die Strahlen durchdringen die Haut und treffen auf die Prostata. Für den Patienten sind diese Strahlen schmerzlos.
Lexikon
Gray (Abkürzung Gy) ist die Einheit, in der die Strahlendosis bei einer Bestrahlung angegeben wird.
Mehr dazu unter Radioaktivität und Strahlung: Quellen, Risiken, Nutzen im Abschnitt "Energie-Einheiten: Wie misst man die Strahlenbelastung?"
Die Strahlentherapie dauert etwa 7 bis 9 Wochen und findet ambulant statt. In der Regel gibt es für einen Patienten 5 Sitzungen pro Woche, dabei erhält er für wenige Minuten eine niedrige Strahlendosis von etwa 1,8 bis 2 Gray (Gy). Der Fachbegriff dafür lautet "fraktionierte Strahlentherapie", "Normofraktionierung" oder "Standardfraktionierung". Danach kann der Patient wieder nach Hause gehen.
- Die gesamte Strahlendosis nach dem Behandlungszeitraum liegt zwischen 74 und 80 Gy – welche Gesamtdosis erforderlich ist, hängt vom Tumorstadium und dem Rückfallrisiko eines Betroffenen ab.
Hypofraktionierte Bestrahlung: Ein Patient erhält bei diesem Vorgehen über einen kürzeren Zeitraum zwar eine höhere Strahlendosis pro Sitzung, über den ganzen Behandlungszeitraum ist die Strahlenmenge dann aber insgesamt niedriger als bei der Standardfraktionierung.
- Die moderate Hypofraktionierung empfehlen Fachleute nur beim örtlich begrenzten Prostatakrebs. Pro Sitzung erhält ein Patient in der Regel eine Strahlendosis von etwa 2,5 bis 3,4 Gy. Die gesamte Strahlendosis liegt je nach Behandlungsschema etwa zwischen 60 Gy (in 20 Sitzungen über 4 Wochen) oder insgesamt 70 Gy (in 28 Sitzungen über 6 Wochen).
- Die extreme Hypofraktionierung mit dem CyberKnife® ist noch kein Standard – Diese Methode ist für einen Patienten mit einer noch höheren Strahlenmenge pro Sitzung (etwa 4 bis 10 Gy) über einen Zeitraum von 1 bis 2,5 Wochen verbunden. Sie kombiniert eine bildgeführte Strahlentherapie (IGRT) mit einer intensiven und präzisen Strahlentherapie, der sogenannten stereotaktischen Bestrahlung (SBRT).
CyberKnife®: Warum noch kein Standard?*
Fachleute empfehlen die extrem hypofraktionierte Bestrahlung derzeit nicht als Ersttherapie – auch wenn diese Technik eine zunehmende Rolle bei der Behandlung von Prostatakrebs spielt und in Deutschland in entsprechend ausgestatteten Zentren angeboten wird.
Der Grund: Die Nachbeobachtungszeiten in den verfügbaren klinischen Studien sind noch zu kurz, um die Wirksamkeit und die Nebenwirkungen abschließend beurteilen zu können.
- Wann Patienten die Bestrahlung mit CyberKnife® als sogenannte fokale Therapie erhalten können, lesen Sie unter Fokale Therapien bei Prostatakrebs: HIFU, photodynamische Therapie und Co.
*Hinweis unter Quellen und Links
Noch Teil der Forschung: Protonentherapie
Die Protonentherapie soll Krebszellen zielgenau zerstören und gesundes Gewebe besser schonen, als das mit bisherigen Strahlentherapien möglich ist.
Bisher sind die Ergebnisse aus Studien zur Protonentherapie bei Prostatakrebs widersprüchlich. Daher gilt dieses Verfahren noch als experimentell. Das bedeutet: Es gibt noch keine aussagekräftigen Belege, dass die Protonentherapie gleichwertig wirksam ist wie die Standardstrahlentherapien (IMRT und IGRT). Zudem gibt es Hinweise aus Studien, dass nach einer Protonentherapie manche Nebenwirkungen häufiger auftreten können als nach einer IMRT.
Nur innerhalb klinischer Studien verfügbar: Aufgrund der bisherigen Forschungsergebnisse können Männer die Protonentherapie nur innerhalb einer klinischen Studie erhalten.
Brachytherapie: Prostatakrebs lokal von innen bestrahlen
Bei einer Brachytherapie erhalten Männer mit Prostatakrebs eine sogenannte Kurzdistanz-Strahlentherapie. Dafür bekommen sie sehr kleine Strahlenquellen in die Prostata eingesetzt. Weil diese Strahlenquellen innerhalb des Prostatagewebes sind, bezeichnen Fachleute die Brachytherapie auch als interstitielle Strahlentherapie.
Es gibt zwei Verfahren:
- LDR Brachytherapie – Bei der Low-Dose-Rate-Brachytherapie bekommen Männer dauerhaft sogenannte Seeds als Strahlenquellen in die Prostata eingebracht. Die Seeds sind reiskorngroße Kapseln mit Jod-125 beziehungsweise Palladium-103 und geben etwa 12 Monate lang eine Strahlung ab, die nur wenige Millimeter weit reicht.
- HDR Brachytherapie – Die High-Dose-Rate-Brachytherapie wird auch Afterloading-Verfahren genannt (englisch für Nachladeverfahren). Bei dieser Technik bleiben die eingebrachten Iridium-192-Strahlenquellen nur kurze Zeit im Körper und werden danach wieder operativ entfernt. Sie geben eine höhere Strahlendosis ab, als die Strahlenquellen bei der LDR Brachytherapie. Auch hier ist die Reichweite der Strahlen sehr gering.
Bin ich nach der Bestrahlung radioaktiv? Schon auf der Haut eines Patienten ist die Strahlung kaum messbar, in 2 Metern Abstand ist sie sogar nicht mehr nachweisbar. Fachleute empfehlen Patienten trotzdem vorsichtshalber, für einige Wochen keine Kleinkinder auf den Schoß zu nehmen. Außerdem sollte man zu Schwangeren einen Abstand von etwa 1 bis 2 Metern halten. Ist das nicht möglich, können Männer Strahlenschutzhosen tragen.
Was lässt sich mit der Brachytherapie erreichen?
Ärzte setzen eine Brachytherapie mit dem Ziel der Heilung ein. Ob eine Brachytherapie infrage kommt und welches der beiden Verfahren Fachleute empfehlen, hängt von der Erkrankungssituation und dem Tumorstadium ab.
LDR Brachytherapie:
- Eine Seed-Einlage ist für Männer mit lokal begrenztem Prostatakrebs und einem geringen Risiko für einen Krankheitsrückfall geeignet.
Sind Behandlungserfolge ebenso gut wie durch Operation oder Bestrahlung von außen? Das können Fachleute noch nicht abschließend beurteilen. Sie gehen aber davon aus, dass sehr viele Patienten mit kleinen, langsam wachsenden Tumoren durch die Brachytherapie mit Seeds geheilt werden können. - Wird die LDR Brachytherapie mit der Bestrahlung von außen und der Hormonentzugstherapie kombiniert, kann sie auch für Patienten der mittleren und hohen Risikogruppe infrage kommen.
HDR Brachytherapie:
- Das Afterloading-Verfahren ist für Männer mit lokal begrenztem Prostatakrebs und einem mittleren oder hohen Risiko für einen Krankheitsrückfall geeignet.
- Auch für Männer mit einem lokal fortgeschrittenen Prostatakrebs kann eine HDR Brachytherapie infrage kommen.
- Für beide Erkrankungssituationen empfehlen Fachleute die HDR Brachytherapie mit einer Bestrahlung von außen zu kombinieren.
Rückfallrisiko
Das Risiko, einen Krankheitsrückfall zu erleiden, hängt von PSA-Wert, Gleason-Score und Tumorstadium ab.
- Mehr dazu lesen Sie unter Diagnose Prostatakrebs: Untersuchungen bei Krebsverdacht im Abschnitt "Befunde verstehen: Ergebnisse der Diagnostik".
So läuft die Brachytherapie ab

Bild: © Pepermpron, Shutterstock (Grafik: redaktionell bearbeitet)
LDR Brachytherapie:
- Der Eingriff ist minimal-invasiv und dauert etwa 1 bis 2 Stunden. Er ist ambulant möglich, in der Regel bleiben Patienten aber 1 bis 2 Tage zur Kontrolle im Krankenhaus.
- Für den Eingriff erhält der Patient eine Voll- oder Teilnarkose. Anschließend werden dem Patienten die Strahlenquellen (Seeds) unter Ultraschallkontrolle über die Haut des Damms in die gesamte Prostata eingesetzt. Dabei nutzt der Arzt oder die Ärztin eine Schablone (Template), um die Seeds über mehrere Hohlnadeln an den vorher berechneten Positionen in der Prostata zu platzieren.
- 4 bis 6 Wochen später: Mithilfe einer Computertomographie wird die Lage der Seeds kontrolliert und wenn nötig angepasst.
Kombinationstherapie
Abhängig vom Rückfallrisiko können Männer mit Prostatakrebs auch eine Brachytherapie kombiniert mit einer Hormonentzugstherapie und Bestrahlung von außen erhalten. Die Strahlendosis der Brachytherapie und der perkutanen Strahlentherapie ist bei der Kombinationstherapie niedriger als bei der alleinigen LDR Brachytherapie oder Bestrahlung von außen.
HDR Brachytherapie:
- Der Eingriff dauert etwa 1 Stunde, die eigentliche Bestrahlung etwa 10 Minuten.
- Dafür erhält ein Patient eine örtliche Betäubung der unteren Körperhälfte oder eine Vollnarkose.
- Unter Ultraschallkontrolle werden an berechneten Stellen Hohlnadeln in die Prostata eingeführt, die danach ein computergesteuerter Roboter mit der Strahlenquelle füllt.
- Die Strahlenquellen werden nach der Bestrahlung wieder entfernt.
- Die Behandlung findet meistens 2 Mal im Abstand von 1 Woche statt.
- An die HDR Brachytherapie schließt sich 4 bis 5 Wochen lang eine perkutane Strahlentherapie mit einer geringeren Strahlendosis (etwa 40 bis 50 Gy) an.
Nuklearmedizin: Therapie mit Medikamenten
Lexikon
Radiopharmakon: Arzneimittel, das eine radioaktive Substanz enthält. Diese gibt im Körper für eine kurze Zeit Strahlung ab.
Radionuklid: Radioaktive Substanz, die kurzzeitig Strahlung abgibt
PSMA (nicht zu verwechseln mit PSA): Abkürzung für "Prostata-spezifisches Membranantigen". Das ist ein Eiweiß, das vermehrt auf der Oberfläche von Prostatakrebszellen vorkommt.
Die Nuklearmedizin umfasst die Therapie mit radioaktiven Arzneimitteln. Das sind Medikamente, die im Körper auf kurze Distanz von wenigen Millimetern Strahlung abgeben. Sie reichern sich gezielt im Tumorgewebe an, sodass ihre Strahlen den Prostatakrebs von innen heraus zerstören. Fachleute bezeichnen das als Radionuklidtherapie oder Radioligandentherapie.
Bei Prostatakrebs gibt es folgende Medikamente:
- Radium-223 (Handelsname Xofigo®, Wirkstoffname Radium-223-dichlorid) – Patienten mit Knochenmetastasen hilft das Medikament, Schmerzen zu lindern.
- Lutetium-177-PSMA-617 (Handelsname Pluvicto®, Wirkstoffname Lutetiumvipivotidtetraxetan) – Das Medikament kommt für Patienten mit fortgeschrittenem Prostatakrebs infrage, wenn andere Therapieoptionen wie Chemotherapie oder Hormontherapie ausgeschöpft sind. Es kann Schmerzen von Patienten lindern, ihre Lebensqualität dadurch verbessern, aber auch das Überleben verlängern.
Schon gewusst?
PSMA ist ein Zielmolekül das sich sowohl für die Diagnostik mit der Positronen-Emissions-Tomographie (PET), als auch für die Therapie mit Lutetium-177-PSMA-617 ansteuern lässt. Deshalb sprechen Fachleute in diesem Zusammenhang auch von "Theranostik" (=Therapie und Diagnostik).
Bin ich nach der Behandlung radioaktiv? Wenn Männer radioaktive Medikamente erhalten, sind diese einige Tage in ihren Körperflüssigkeiten nachweisbar. Patienten scheiden sie hauptsächlich mit dem Stuhl und Urin aus, aber auch mit Erbrochenem. Daher empfehlen Fachleute in der ersten Woche nach der Behandlung Patienten beispielsweise
- nach dem Toilettengang 2 Mal die Hände zu waschen,
- die Toilette 2 Mal zu spülen und
- verschmutzte Kleidung oder Bettwäsche separat zu waschen.
Weitere hilfreiche Hinweise: Wie lange Männer nach der Therapie beispielsweise engen Kontakt meiden oder auf sexuelle Aktivitäten verzichten sollten, lesen Sie im Leitfaden zu Lutetium-177-PSMA (PDF). Bei diesem Leitfaden handelt es sich um Schulungsmaterial, das von den Arzneimittelbehörden genehmigt wurde.
Was lässt sich mit Nuklearmedizin erreichen?
Lexikon
Systemische Therapie: Krebserkrankte erhalten Medikamente, die im gesamten Körper wirken.
Radionuklidtherapie mit Radium-223: Der Wirkstoff kann bei Patienten das Tumorwachstum hemmen und Beschwerden verringern. Eine dauerhafte Heilung ist mit dieser Therapie aber nicht möglich.
Voraussetzungen für die Therapie mit Radium-223:
- Die Männer leiden unter Knochenmetastasen, aber sind ansonsten in guter gesundheitlicher Verfassung und haben keine Metastasen in Lunge, Leber oder Gehirn.
- Radium-223 wird als Drittlinientherapie eingesetzt. Das bedeutet, die Patienten haben vorher mindestens 2 medikamentöse Therapien erhalten oder es ist keine andere medikamentöse Therapie mehr geeignet.
Radionuklidtherapie mit Lutetium-177-PSMA: Mit dieser Therapie ist keine Heilung möglich. Aber der PSA-Wert im Blut kann deutlich abfallen, tumorbedingte Schmerzen lassen sich lindern und die Zahl und Größe der Metastasen kann nach der Therapie abnehmen. Zudem kann die Behandlung dazu beitragen, das Überleben von Männern zu verlängern.
- Gut zu wissen: Die Therapie ist seit dem 13. Dezember 2022 auch in Europa zugelassen. Patienten können sie daher außerhalb klinischer Studien erhalten.
Voraussetzungen für die Therapie mit Lutetium-177-PSMA:
- Der Patient ist in guter gesundheitlicher Verfassung.
- Es gibt keine anderen verfügbaren Therapieoptionen mehr.
- Die behandelnden Ärzte empfehlen die Radionuklidtherapie.
- Der Tumor beziehungsweise die Metastasen sind mithilfe eines bildgebenden Verfahrens, der PSMA-Positronen-Emissions-Tomographie (PSMA-PET), auffindbar.
So läuft die Therapie ab
Bild: © yacobchuk, iStock
Radionuklidtherapie mit Radium-223:
- Vor Therapiebeginn, während und nach der Behandlung mit Radium-223 werden Patienten auf ihr Risiko für Knochenbrüche untersucht. Um Knochenbrüchen vorzubeugen, erhalten sie gegebenenfalls eine Knochen-stabilisierende Therapie mit Denosumab oder Bisphosphonaten.
- Für die Therapie erhalten Männer das radioaktive Medikament in die Vene gespritzt: im Abstand von 4 Wochen in bis zu 6 Sitzungen.
- Nach der Therapiesitzung kann der Patient in der Regel nach Hause gehen und muss nicht stationär in der Klinik bleiben.
Immer als Kombinationstherapie
Eine Radionuklidtherapie mit Lutetium-177-PSMA erhalten Patienten immer zusammen mit einer klassischen Hormonentzugstherapie und/oder einer neuen hormonellen Substanz.
Radionuklidtherapie mit Lutetium-177-PSMA:
- Vor der Therapie machen Ärzte zunächst eine bildgebende Untersuchung, die sogenannte "PSMA-PET".
- Für die Therapie bekommt der Patient das Lutetium-177-PSMA in die Vene gespritzt. Danach muss er etwa 2 bis 4 Tage stationär im Strahlenschutzbereich bleiben, bevor er nach Hause kann.
- Nach 4 Wochen werden der PSA-Wert und weitere Blutwerte bestimmt. Wirkt die Therapie, bekommt der Patient 6 bis 8 Wochen später die nächste Behandlung.
- Nach 3 Behandlungsterminen folgt eine weitere PSMA-PET-Untersuchung. Danach entscheidet das Ärzteteam, ob weitere Behandlungstermine infrage kommen. Entscheidend dafür sind auch die Blut- und Nierenwerte.
Zum Weiterlesen
Wie eine "PSMA-PET" abläuft, lesen Sie unter Diagnose Prostatakrebs: Untersuchungen bei Krebsverdacht im Abschnitt "Bildgebung: MRT, CT und weitere Verfahren".
Was der Unterschied zwischen der klassischen Hormontherapie und den neuen hormonellen Substanzen ist und welche Medikamente es genau gibt, lesen Sie unter Hormontherapie bei Prostatakrebs.
Nebenwirkungen und Langzeitfolgen einer Strahlentherapie
Wichtig zu wissen
Welche Nebenwirkungen durch die Strahlentherapie auftreten und in welchem Umfang, hängt von der eingesetzten Technik sowie der Dosis ab und kann individuell verschieden sein. Nicht alle Männer leiden gleichermaßen unter Nebenwirkungen einer Strahlentherapie.
Männer können schon während der Bestrahlung von Nebenwirkungen betroffen sein – welche Beschwerden das sind, hängt von der Strahlendosis ab und davon, wie groß das notwendige Bestrahlungsfeld ist. Die Beschwerden treten in der Regel erst nach einigen Wochen auf und klingen mit dem Ende der Strahlentherapie häufig wieder ab. Fachleute bezeichnen solche Beschwerden als akute Nebenwirkungen.
Spätfolgen sind Beschwerden, die mehr als 90 Tage nach einer Bestrahlung auftreten. Sie entwickeln sich entweder aus akuten Nebenwirkungen oder erst nach Monaten oder Jahren. Solche Spätfolgen können vorübergehend oder dauerhaft sein. Sie können sich mit der Zeit verbessern, aber auch verschlechtern.
Nebenwirkungen bei einer Bestrahlung von außen

Bild: © Krebsinformationsdienst, DKFZ; Foto: Tobias Schwerdt
Nach einer Bestrahlung von außen haben Männer in der Regel nach 3 bis 4 Wochen die ersten Nebenwirkungen. Dazu gehören etwa:
- Hautbeschwerden – Während der Bestrahlung kann die Haut im Bestrahlungsbereich leicht anschwellen und gerötet sein und jucken (akute Radiodermatitis).
- Müdigkeit (Fatigue) – Viele Patienten sind aufgrund der Bestrahlung sehr müde und erschöpft.
- Entzündungen der Schleimhäute in Harnblase und Harnröhre – Etwa 33 von 100 Männern leiden dadurch unter einem schmerzhaften Harndrang und erschwertem Wasserlassen, Harnverhalt in der Nacht und vermehrtem Harndrang.
- Entzündung der Enddarmschleimhaut – Dadurch können Betroffene einen schmerzhaften Stuhlgang, Durchfall und eventuell leichte Blutungen haben. Etwa 10 bis 20 von 100 Patienten sind davon betroffen.
Mögliche Spätfolgen:
- Hautveränderungen – Wunden im bestrahlten Hautbereich können schlechter heilen, gerötet sein, schmerzen und jucken. Die Haut kann zudem chronisch trocken, empfindlich und verstärkt verletzlich sein.
- Erektile Dysfunktion – Innerhalb von 2 bis 5 Jahren lässt die Erektionsfähigkeit bei vielen Männern nach oder geht ganz verloren. Nach einer OP sind aber vergleichsweise mehr Männer davon betroffen. Eine Erektionsschwäche lässt sich nach einer perkutanen Bestrahlung in der Regel mit Medikamenten behandeln.
- Chronische Darmentzündung – Häufiger als nach einer OP oder einer Brachytherapie haben Männer eine chronische Darmentzündung und dadurch Probleme mit dem Stuhlgang. Sie haben beispielsweise öfter Durchfall.
- Inkontinenz – Seltener als nach einer OP oder einer Brachytherapie können Männer ihren Urinabgang dauerhaft nicht mehr kontrollieren.
Nebenwirkungen einer Brachytherapie

Bild: © shisu_ka, Shutterstock
Nach einer Brachytherapie treten in der Regel innerhalb von etwa 3 bis 6 Monate die meisten Beschwerden auf.
Nebenwirkungen während der Therapie:
- Entzündung der Harnröhre und Blase – Dadurch ist für Männer das Wasserlassen häufig schmerzhaft, vor allem nachts. Die Beschwerden können auch nach der Therapie einige Monate anhalten. Kann der Urin aufgrund einer Schwellung der Prostata nicht abfließen, erhalten Patienten vorübergehend einen Blasenkatheter.
- Entzündung der Enddarmschleimhaut – Sie kann Schmerzen, Blutungen und Schleimabgang verursachen.
Nebenwirkungen nach der Therapie:
- Anhaltende Darmprobleme – Männer haben beispielsweise häufiger Durchfall.
- Erektile Dysfunktion – Nach 2 bis 5 Jahren haben viele Männer Erektionsprobleme. Die Erektionsstörungen lassen sich aber in der Regel mit Medikamenten behandeln.
- Störung der Blasenfunktion – Selten bleibt bei Männern die Harnröhre verengt, das verursacht Harnentleerungsstörungen. Bei etwa 10 bis 15 von 100 Männern ist diese Störung nur vorübergehend. Bei wenigen Männern kann die Störung dauerhaft bleiben. Es kann auch passieren, dass Männer ihren Urinabgang dauerhaft nicht mehr kontrollieren können (Inkontinenz).
- Nur bei der LDR Brachytherapie: Seed-Migration – Die dauerhaft eingesetzten Strahlenquellen können über die Blutbahn in andere Organe wandern (Seed-Migration). Männer können sie aber auch über den Harntrakt ausscheiden. Bei der HDR Brachytherapie passiert das in der Regel nicht, da die Ärzte die Strahlenquellen nach einem festgelegten Zeitraum wieder entfernen.
Wichtig zu wissen: Weil Männer die HDR Brachytherapie nur in Kombination mit mindestens einer zusätzlichen äußeren (perkutanen) Bestrahlung erhalten, können die Nebenwirkungen entsprechend stärker ausfallen als bei einer alleinigen LDR Brachytherapie.
Nebenwirkungen der nuklearmedizinischen Therapie

Bild: © Krebsinformationsdienst, DKFZ; Foto: Tobias Schwerdt
Nebenwirkungen nach einer Therapie mit Radium-223:
- Magen-Darm-Probleme – Männer leiden oftmals unter Übelkeit, Durchfall und Erbrechen, wodurch sie zu viel Flüssigkeit verlieren können.
- Leukozytopenie – Eine verminderte Anzahl weißer Blutkörperchen (Leukozyten) erhöht das Risiko für Infektionen.
- Thrombozytopenie – Ist die Anzahl der Blutplättchen (Thrombozyten) verringert, haben Männer ein erhöhtes Risiko für Blutungen. Um das zu vermeiden, erhalten Patienten Thrombozytentransfusionen.
- Erhöhtes Risiko für Knochenbrüche – Um dem Risiko entgegenzuwirken, erhalten Patienten gleichzeitig zur Radionuklidtherapie eine Knochen-stabilisierende Therapie.
- Hautreaktionen – Die Injektionsstelle kann anschwellen, gerötet sein und dies kann Schmerzen verursachen.
Nebenwirkungen nach einer Therapie mit Lutetium-PSMA:
- Mundtrockenheit – Etwa 33 von 100 Männern leiden wenige Tage nach der Therapie unter Mundtrockenheit, da sich Therapie auch gegen das PSMA der Speicheldrüsen richtet. Diese Nebenwirkung ist in der Regel mild und meist vorübergehend. Manchmal können die Symptome aber auch eine Weile anhalten.
- Leichte Übelkeit – Weil PSMA auch im Dünndarm vorhanden ist, kann einem Mann nach der Therapie leicht übel werden.
- Müdigkeit und Erschöpfung (Fatigue) – Viele Männer fühlen sich nach der Therapie sehr müde und sind erschöpft.
- Anämie – Selten verringert sich durch die Therapie die Anzahl der roten Blutkörperchen. Anzeichen dafür sind eine blasse Hautfarbe, Probleme sich zu konzentrieren, eine geringe körperliche Belastbarkeit und Müdigkeit.
- Thrombozytopenie – Ist die Anzahl der Blutplättchen (Thrombozyten) verringert, haben Männer ein erhöhtes Risiko für Blutungen. Um das zu vermeiden, erhalten Patienten Thrombozytentransfusionen.
Quellen und Links für Interessierte und Fachkreise
Hinweis
Der Begriff "Cyberknife" ist ursprünglich ein Markenname für ein Bestrahlungsgerät, daneben gibt es weitere Hersteller vergleichbarer Bestrahlungsgeräte. Weil sich der Begriff unter Krebserkrankten und Fachleuten im Sprachgebrauch etabliert hat und Betroffene nach diesem Begriff im Internet suchen, verwenden wir diesen Begriff ebenfalls auf unserer Website.
Der Krebsinformationsdienst hat zur Erstellung des Textes im Wesentlichen auf die S3-Behandlungsleitlinie deutscher Fachgesellschaften zurückgegriffen. Diese und weitere Quellen sowie nützliche Links sind in der Übersicht zum Thema Prostatakrebs aufgeführt.
Fachartikel (Auswahl)
Bagshaw HP, Arnow KD, Trickey AW, Leppert JT, Wren SM, Morris AM. Assessment of Second Primary Cancer Risk Among Men Receiving Primary Radiotherapy vs Surgery for the Treatment of Prostate Cancer. JAMA Netw Open. 2022 July; 5(7):e2223025. doi:10.1001/jamanetworkopen.2022.23025
Bottke D, Bartkowiak D, Siegmann A, Thamm R, Böhmer D, Budach V, Wiegel T. Effect of early salvage radiotherapy at PSA < 0.5 ng/ml and impact of post-SRT PSA nadir in post-prostatectomy recurrent prostate cancer. Prostate Cancer Prostatic Dis. 2019 May; 22(2):344-349. doi: 10.1038/s41391-018-0112-3.
Giberti C, Gallo F, Schenone M, Gastaldi E, Cortese P, Ninotta G, Becco D. Robotic prostatectomy versus brachytherapy for the treatment of low risk prostate cancer. Can J Urol. 2017 Apr; 24(2):8728-8733. PMID: 28436359.
Goy BW, Burchette R, Soper MS, Chang T, Cosmatos HA. Ten-Year Treatment Outcomes of Radical Prostatectomy Vs External Beam Radiation Therapy Vs Brachytherapy for 1503 Patients With Intermediate-risk Prostate Cancer. Urology. 2020 Feb; 136:180-189. doi: 10.1016/j.urology.2019.09.040.
Haberkorn U, Eder M, Kopka K, Babich JW, Eisenhut M. New Strategies in Prostate Cancer: Prostate-Specific Membrane Antigen (PSMA) Ligands for Diagnosis and Therapy. Clin Cancer Res. 2016 Jan 1; 22(1):9-15. doi: 10.1158/1078-0432.CCR-15-0820.
Hofman MS, Violet J, Hicks RJ, Ferdinandus J, Thang SP, Akhurst T, Iravani A, Kong G, Ravi Kumar A, Murphy DG et al. [177Lu]-PSMA-617 radionuclide treatment in patients with metastatic castration-resistant prostate cancer (LuPSMA trial): a single-centre, single-arm, phase 2 study. Lancet Oncol. 2018 Jun; 19(6):825-833. doi: 10.1016/S1470-2045(18)30198-0.
Jackson WC, Hartman HE, Dess RT, Birer SR, Soni PD, Hearn JWD, Reichert ZR, Kishan AU, Mahal BA, Zumsteg ZS et al. Addition of Androgen-Deprivation Therapy or Brachytherapy Boost to External Beam Radiotherapy for Localized Prostate Cancer: A Network Meta-Analysis of Randomized Trials. J Clin Oncol. 2020 Sep 10; 38(26):3024-3031. doi: 10.1200/JCO.19.03217.
Parker CC, Clarke NW, Cook AD, Kynaston HG, Petersen PM, Catton C, Cross W, Logue J, Parulekar W, Payne H et al. Timing of radiotherapy after radical prostatectomy (RADICALS-RT): a randomised, controlled phase 3 trial. Lancet. 2020 Oct 31; 396(10260):1413-1421. doi: 10.1016/S0140-6736(20)31553-1.
Parker CC, James ND, Brawley CD, Clarke NW, Hoyle AP, Ali A, Ritchie AWS, Attard G, Chowdhury S, Cross W et al. Systemic Therapy for Advanced or Metastatic Prostate cancer: Evaluation of Drug Efficacy (STAMPEDE) investigators. Radiotherapy to the primary tumour for newly diagnosed, metastatic prostate cancer (STAMPEDE): a randomised controlled phase 3 trial. Lancet. 2018 Dec 1; 392(10162):2353-2366. doi: 10.1016/S0140-6736(18)32486-3.
Rahbar K, Ahmadzadehfar H, Kratochwil C, Haberkorn U, Schäfers M, Essler M, Baum RP, Kulkarni HR, Schmidt M, Drzezga A et al. German Multicenter Study Investigating 177Lu-PSMA-617 Radioligand Therapy in Advanced Prostate Cancer Patients. J Nucl Med. 2017 Jan; 58(1):85-90. doi: 10.2967/jnumed.116.183194.
Routman DM, Funk RK, Stish BJ, Mynderse LA, Wilson TM, McLaren R, Harmsen WS, Mara K, Deufel CL, Furutani KM et al. Permanent prostate brachytherapy monotherapy with I-125 for low- and intermediate-risk prostate cancer: Outcomes in 974 patients. Brachytherapy. 2019 Jan-Feb; 18(1):1-7. doi: 10.1016/j.brachy.2018.09.003.
Sartor O, de Bono J, Chi KN, Fizazi K, Herrmann K, Rahbar K, Tagawa ST, Nordquist LT, Vaishampayan N, El-Haddad G; VISION Investigators et al. Lutetium-177-PSMA-617 for Metastatic Castration-Resistant Prostate Cancer. N Engl J Med. 2021 Sep 16; 385(12):1091-1103. doi: 10.1056/NEJMoa2107322.
Sun M, Niaz MJ, Niaz MO, Tagawa ST. Prostate-Specific Membrane Antigen (PSMA)-Targeted Radionuclide Therapies for Prostate Cancer. Curr Oncol Rep. 2021 Mar 29; 23(5):59. doi: 10.1007/s11912-021-01042-w.