- Genetische Daten sind wichtig für die Krebsforschung: Forschende können Krebs mit solchen Daten besser verstehen und dadurch die Therapie und Versorgung von Betroffenen verbessern.
- Genetische Daten sind besonders sensible personenbezogene Daten: Sie können Auskunft über die Erbinformation eines Menschen und das Risiko für bestimmte Krankheiten geben.
- Ohne eine Erlaubnis der Betroffenen dürfen Forschende nicht mit den genetischen Daten arbeiten.
Was Sie zu genetischen Daten wissen sollten: Wichtiges in Kürze
Wenn Krebspatientinnen und Krebspatienten an klinischen Studien teilnehmen, verwenden die Forschenden manchmal auch ihre genetischen Daten. Wir erklären, was genetische Daten eigentlich sind und wie sie helfen können, die Behandlung von Krebs zu verbessern.
Genetische Daten in der Krebsforschung
Genetische Daten: Was ist das?
Lexikon
Desoxyribonukleinsäure (oft abgekürzt als DNS) ist die deutsche Übersetzung von deoxyribonucleic acid.
Alle Informationen, die sich aus der Erbinformation eines Menschen ableiten lassen, sind genetische Daten. Jede Zelle im Körper speichert die Erbinformation auf der sogenannten DNA (Abkürzung für englisch deoxyribonucleic acid).
Das bedeutet: Man kann Erbinformation aus jedem Gewebe, Organ, aber auch aus den Haaransätzen gewinnen. Weil Körperzellen auch zerfallen und DNA nach außen abgeben können, kann man DNA sogar in Körperflüssigkeiten einer Person finden.

Bild: © Djomas, Shutterstock
Die DNA gibt wie ein Bauplan vor, was jeder Mensch von Geburt an mitbringt: von körperlichen Merkmalen wie der Haar- oder Hautfarbe bis hin zum Risiko, bestimmte Krankheiten zu bekommen. Im Laufe des Lebens können auch Veränderungen in der DNA stattfinden. Dadurch können Menschen genetische Eigenschaften erwerben, die nicht ererbt sind.
Für die Erforschung und Nutzung genetischer Daten macht es einen Unterschied, ob genetische Eigenschaften ererbt oder erworben sind.
Ererbte genetische Eigenschaften: Sie können Hinweise zum Risiko einer Person für bestimme Krankheiten liefern, bevor diese Person überhaupt Beschwerden oder Symptome hat – das gilt auch für Krebs. Ererbte genetische Eigenschaften werden über Ei- und Samenzellen, die sogenannte Keimbahn, von Generation zu Generation weitergegeben – also an Blutsverwandte.
Erworbene genetische Eigenschaften: Sie sind nur in Zellen einer Person nachweisbar, in den Zellen von Blutsverwandten hingegen in aller Regel nicht. Meist sind sie auch nicht in allen Zellen dieser Person zu finden, sondern nur in bestimmten Geweben: zum Beispiel in den Tumorzellen einer an Krebs erkrankten Person. Für die Krebsforschung sind gerade diese erworbenen genetischen Eigenschaften in den Krebszellen von Erkrankten von Bedeutung. Sie können Hinweise geben, wie die Erkrankung wahrscheinlich verlaufen wird und wie man sie behandeln kann.
Gut zu wissen
Je nachdem, welche genetischen Eigenschaften der Tumor einer Patientin oder eines Patienten hat, können bestimmte Therapien geeigneter sein als andere.
Genetische Daten sind besonders sensibel
Lexikon
Personenbezogene Daten sind Informationen, die sich auf eine bestimmte Person beziehen und sich genau dieser Person zuordnen lassen.
Gesundheitsdaten beziehen sich auf den Gesundheitszustand einer Person. Dazu gehören etwa Laborergebnisse, Diagnosen oder medizinische Befunde, also auch genetische Daten.
Genetische Daten sind Gesundheitsdaten und in der Regel besonders sensible personenbezogene Daten:
- Im Vergleich zu beispielsweise einem aktuellen Laborwert oder einer Computertomographie-Aufnahme sind genetische Daten keine Momentaufnahme des Gesundheitszustands einer Person. Insbesondere vererbbare genetische Veränderungen (Keimbahn- Veränderungen) haben eine lebenslange Aussagekraft.
- Wenn genetische Untersuchungen Keimbahn-Veränderungen aufdecken, ermöglicht dies auch Rückschlüsse auf die Veranlagung für bestimmte Erkrankungen.
- Solche Rückschlüsse lassen sich gegebenenfalls auch auf Blutsverwandte übertragen.
- Schon kleine Abschnitte der DNA sind ausreichend, um die genetischen Daten einer Person zuordnen und über diese Person Rückschlüsse ziehen zu können.
Besonderer Schutz auf rechtlicher Ebene
Weil genetische Daten sehr sensibel sind, sind sie besonders schützenswert. Der Umgang mit solchen Daten ist daher in der Datenschutz-Grundverordnung (DSGVO) streng geregelt.
Krebsforschung: Welche Rolle spielen genetische Daten?

Bild: © Arek Socha, Pixabay
Mithilfe von genetischen Daten wollen Forschende die Behandlung und Versorgung von Krebserkrankten verbessern, genauso wie die Früherkennung von Krebs.
Forschende untersuchen etwa, ob und wie genau sich die Erbinformation im Tumor eines Krebspatienten oder einer Krebspatientin im Vergleich zu gesundem Gewebe verändert hat.
Manchmal werden solche Veränderungen in der Erbinformation eines Tumors auch "genetischer Marker" genannt. Sie gehören zu den Biomarkern.
So lassen sich genetische Daten nutzen
Forschende können untersuchen, wie sich veränderte Erbinformationen auswirken: Leben zum Beispiel Betroffene mit einer bestimmten Veränderung länger oder kürzer als Betroffene ohne diese Veränderung? Dadurch lassen sich möglicherweise neue Therapien mit weniger Nebenwirkungen entwickeln oder Therapien, die bei Betroffenen mit genetischen Veränderungen besonders gut wirken.
Wirkt eine Therapie besonders gut bei Patientinnen und Patienten mit bestimmten genetischen Markern, kann diese Behandlung anderen Erkrankten mit denselben Markern im Tumorgewebe möglicherweise auch helfen – auch wenn sie gar nicht an derselben Krebsart erkrankt sind.
Aus genetischen Daten können Forschende auch oft ableiten, wie der voraussichtliche Krankheitsverlauf (Prognose) eines Krebserkrankten sein wird und/oder ob eine Therapie einer Patientin oder einem Patienten voraussichtlich helfen kann.
So nutzt das DKFZ genetische Daten
Auch am Deutschen Krebsforschungszentrum (DKFZ) arbeiten Forschende mit genetischen Daten. Ziel ist es, Gemeinsamkeiten und Unterschiede im Tumor im Vergleich mit gesundem Gewebe eines Patienten oder einer Patientin zu finden.
Anhand dieser genetischen Daten kann das DKFZ beispielsweise in Studien untersuchen, ob es für Betroffene mit bestimmten Mustern im Tumor weitere Therapieoptionen gibt.
Zum Weiterlesen
Die genetische Daten für solche Studien erhält das DKFZ entweder aus eigenen Projekten wie zum Beispiel aus dem INFORM-Programm oder dem MASTER-Programm.
Forschende des DKFZ nutzen aber auch genetische Daten aus anderen klinischen Studien. Das bezeichnen Fachleute dann als sogenannte Sekundärnutzung.
Sekundärnutzung von genetischen Daten
Für die Krebsforschung ist es wichtig, genetische Daten aus Studien oder Projekten für andere Forschende zugänglich zu machen (Sekundärnutzung). Neben einem verantwortungsvollen Umgang mit solchen Daten, erfordert das zudem eine Einwilligung der Studienteilnehmenden. Die Forschenden außerhalb der ursprünglichen Studie erhalten die genetischen Daten in dieser Situation pseudonymisiert oder faktisch anonymisiert.
Wie gewinnen und nutzen Forschende genetische Daten?
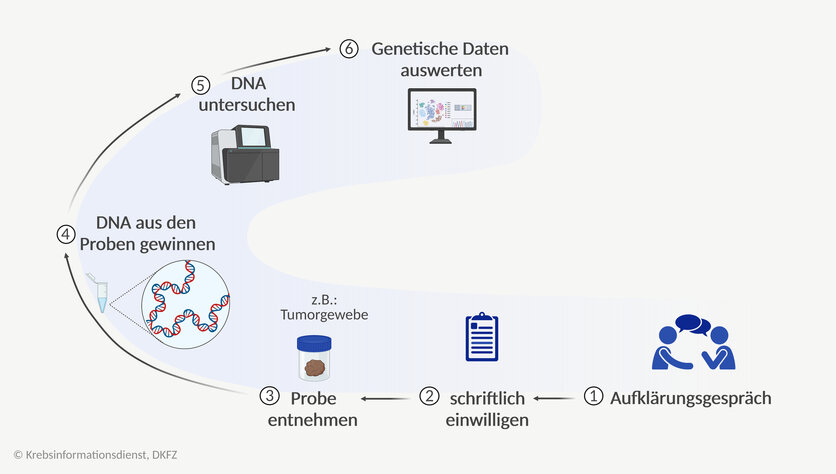
Bild: © Krebsinformationsdienst, DKFZ; erstellt mit BioRender.com
Welche Untersuchungen sind damit verbunden?
- Manchmal reicht eine Blutabnahme oder eine Speichelprobe aus.
- Gewebe aus dem Tumor können Ärzte bei einer Biopsie entnehmen.
- Um andere Körperflüssigkeiten wie etwa Hirnflüssigkeit zu entnehmen, gibt es verschiedene spezielle Techniken. Mit einer Lumbalpunktion können Ärzte beispielsweise Gehirn-Rückenmark-Flüssigkeit entnehmen. Die Verfahren, bei denen Forschende Körperflüssigkeiten entnehmen, um Informationen zu gewinnen, bezeichnen Fachleute als Liquid Biopsy.
Aus diesen Proben können Forschende im Labor DNA gewinnen und für weitere Untersuchungen nutzen, wie etwa
- Gesamtgenomanalysen: Forschende können mit einem sogenannten Sequenzier-Gerät das gesamte Erbmaterial einer Person entschlüsseln und es auf Veränderungen untersuchen.
- Exomsequenzierung: Damit lässt sich der Anteil des Erbmaterials sequenzieren, der die Bauanleitungen für Eiweiße enthält.
- Panelsequenzierung: Forschende entschlüsseln nur die bereits bekannten Abschnitte, die bei der Entwicklung von Krebs oder einer bestimmten Krebsart eine Rolle spielen.
Informed consent: Was bedeutet “informierte Einwilligung“?
Jeder Mensch hat das Recht zu bestimmen, welche seiner personenbezogenen Informationen in welchem Umfang von welchen Personen oder Institutionen genutzt werden dürfen (informationelle Selbstbestimmung) – dazu zählen auch genetische Daten.
Informierte Einwilligung: Patientinnen und Patienten müssen schriftlich zustimmen, bevor Forschende ihre genetischen Daten nutzen können. Vorher findet ein Aufklärungsgespräch statt. Forschende informieren den Patienten oder die Patientin dabei
- über das Ziel der Studie,
- was mit den genetischen Daten gemacht werden soll,
- wo die Daten gesammelt werden sollen
- und fragen, ob erhobene Daten und entnommene Proben danach auch weiter (sekundär) für die Forschung genutzt werden dürfen.
Recht auf Nichtwissen: Jede Person kann frei entscheiden, ob sie über sogenannte medizinische Zusatzbefunde informiert werden möchte. Denn bei einer Studie mit genetischen Daten können Ergebnisse aus Untersuchungen möglicherweise auf eine bisher nicht erkannte Krankheit oder ein Erkrankungsrisiko hinweisen.
Was passiert mit Daten und Proben nach der Studie?

Bild: © German BioBank Node
Nach der Studie können nicht verwendete Biomaterialien, also alle Proben eines Patienten oder einer Patientin, in einer sogenannten Biobank gelagert werden. Diese Proben können nach Ende der Studie für zukünftige Forschungsvorhaben verwendet werden, sofern die Patientin oder der Patient zustimmt/zugestimmt hat. Die genaue Lagerungszeit ist in der zuvor vom Patienten oder der Patientin unterschriebenen Einwilligung festgelegt.
- Wichtig zu wissen: Sie können jederzeit Ihre Einwilligung widerrufen.
Alle Informationen, die im Rahmen von Studien gewonnen werden, speichern die Forschenden digital. Die Datenspeicher von genetischen Daten werden besonders gut geschützt. Mehr dazu lesen Sie in dem Abschnitt Datenschutz: Wie sicher sind meine genetischen Daten?.
Zum Weiterlesen
Weitere Informationen zu Biobanken lesen Sie unter Biopsie: So werden Gewebeproben entnommen im Abschnitt "Biobanken: Probenmaterial für die Forschung spenden".
Datenschutz: Wie sicher sind genetische Daten?
Weil sich genetische Daten einer bestimmten Person zuordnen lassen, werden sie besonders geschützt. Daher ist der Umgang mit sowie die Weitergabe solcher Daten in der Datenschutz-Grundverordnung (DSGVO) streng geregelt. Wer mit genetischen Daten arbeitet, muss diese zudem auf technischer Ebene besonders schützen.
DSGVO: Schutz auf gesetzlicher Ebene

Bild: © MasterTux, Pixybay
Seit 2018 regelt die Datenschutz-Grundverordnung (DSGVO) streng, wie Forschende genetische Daten erheben, speichern, weitergeben und nutzen dürfen. Die DSGVO gilt europaweit.
Unterschiede im Datenschutz: Es gibt bestimmte Bereiche, die ein Gesetzgeber in jedem Land abweichend von der DSGVO regeln kann. Daher kann es passieren, dass sich die Vorgaben auch innerhalb Deutschlands von Bundesland zu Bundesland unterscheiden.
Lexikon
Ethikkommission: Unabhängiges Gremium aus Patientenvertretern und Fachleuten aus verschiedenen Bereichen, wie beispielsweise aus Philosophie, Recht oder Studiendesign.
Mehr zu den Aufgaben einer Ethikkommission lesen Sie unter Krebsforschung und klinische Studien im Abschnitt "Rechtliche Basis: Gesetze, Verordnungen und zuständige Behörden".
Bevor eine Studie mit genetischen Daten überhaupt beginnen kann, prüft eine Ethikkommission,
- ob die Frage der Studie einen wissenschaftlichen Wert hat und sich mit der Anzahl der Teilnehmenden zu dieser Frage auch Aussagen treffen lassen.
- inwiefern Patientendaten aus datenschutzrechtlicher Sicht gefährdet sind.
- ob der Nutzen im Vergleich zum möglichen Schaden für Studienteilnehmende höher ist.
- ob die Dokumente für das Aufklärungsgespräch verständlich sind und alle wichtigen Informationen für die Teilnehmenden enthalten.
Datenschutzkonzept für jede Studie? Bei der Planung einer klinischen Studie können sich Forschende von Datenschutzbeauftragten beraten lassen. Gesetzlich vorgeschrieben ist dies allerdings nicht. Nach Beginn der klinischen Studie prüfen die zuständigen Datenschutzbeauftragten stichprobenartig, ob Forschende den Datenschutz ordnungsgemäß einhalten. Gibt es konkrete Beschwerden, etwa von Studienteilnehmenden, folgt eine Kontrolle durch die Datenschutzbehörde.
Mehrfacher Schutz auf technischer Ebene
Gut zu wissen
Bei der Forschung mit genetischen Daten entstehen sehr große Datenmengen: bis zu 50 bis 70 Gigabyte Daten bei einer einzigen Person. Das entspricht etwa dem Speicher von 12 DVDs.
Erheben Forschende genetische Daten, speichern sie diese in digital vernetzten Computern – sogenannten Computerclustern. Diese Cluster sind durch das Sicherungssystem (Firewall) der jeweiligen Einrichtung oder Klinik geschützt und haben zusätzlich eine eigene Firewall. Das soll die sensiblen Daten vor unerwünschten Zugriffen schützen.
Streng überwachter Zugang: Neben dem Schutz durch 2 Sicherheitssysteme ist zudem der Zugriff auf die genetischen Daten selbst stark eingeschränkt. In der Regel darf nur ein begrenzter Personenkreis auf diese Daten zugreifen: die Menschen, die auch die Daten verarbeiten. In einem Protokoll lässt sich dabei jeder Zugriff auf die Daten nachvollziehen.
Daten zusätzlich pseudonymisiert oder faktisch anonymisiert: Als weitere Schutzmaßnahme werden genetische Daten nicht mit den Klarnamen der Studienteilnehmenden gespeichert. Dann sind mehrere Datenquellen nötig, um die genetischen Daten auch einer Person zuordnen zu können.
- Bei pseudonymisierten Daten sind die genetischen Daten einer Person einer Nummer (ID) zugeordnet. Die personenbezogenen Daten wie Name, Vorname, Geburtsdatum oder andere klinische Untersuchungsergebnisse liegen wiederum auf einem separaten System ab.
- Faktisch anonym sind Daten, wenn sie nur mit einem gewissen Aufwand einer Person zugeordnet werden können. Eine faktische Anonymisierung schließt die Identifizierung einer Person aber nicht gänzlich aus.
- Anonymisiert sind genetische Daten erst, wenn sie im Rahmen der Forschung zu Statistiken zusammengefügt werden. Dann lässt sich kein Zusammenhang zwischen einer Person und ihren genetischen Daten herstellen.
Gibt es Risiken im Umgang mit genetischen Daten?
Wichtig zu wissen
Untersuchungsergebnisse können unter Umständen auch für die Gesundheit der eigenen Blutsverwandten von Bedeutung sein.
Zusätzliche Untersuchungsergebnisse: Forschende können bei genetischen Untersuchungen auch Hinweise auf vorher nicht bekannte Erkrankungen oder Erkrankungsrisiken finden. Patientinnen und Patienten entscheiden vorab, ob sie über solche Untersuchungsergebnisse informiert werden möchten (Recht auf Nichtwissen).
Auskunftspflicht: Wer an einer Studie teilnimmt und über die Ergebnisse der genetischen Tests informiert werden möchte, sollte beachten, dass er diese Ergebnisse unter Umständen bei anderen Stellen melden muss. Dazu zählen beispielsweise manche Versicherungen von mehr als 300.000 Euro oder mit mehr als 30.000 Euro Jahresrente.
- Wichtig: Die Auskunftspflicht gilt nur, wenn jemand vor Abschluss des Vertrages die Testergebnisse vorliegen hat. Wenn zum Zeitpunkt des Vertragsabschlusses noch keine Ergebnisse vorliegen, müssen sie auch nicht nachgereicht werden.
Rückverfolgbarkeit der Daten: Es gibt ein Restrisiko, dass sich solche Studiendaten durch zusätzliche Informationen wie etwa aus dem Internet oder den sozialen Netzwerken einer Person zuordnen lassen. Das gilt besonders für Personen, die selbst genetische oder andere Gesundheitsdaten, etwa zur Ahnenforschung im Internet, veröffentlichen. Es liegt also auch in der Verantwortung jeder und jedes Einzelnen, mit den eigenen genetischen Daten verantwortungsvoll umzugehen.
Datenpannen: Auch, wenn es zahlreiche Sicherheitsmaßnahmen gibt, lassen sich Datenpannen ebenfalls nicht völlig ausschließen. In einer solchen Situation könnten Informationen zum Gesundheitszustand einer Person in die falschen Hände gelangen. Fachleute schätzen dieses Risiko etwa aufgrund von Hackerangriffen als eher gering ein.
Quellen und Links für Interessierte und Fachkreise
Im Folgenden finden Sie eine Auswahl an hilfreichen Links zum Weiterlesen und Quellen, die für die Erstellung dieses Textes genutzt wurden.
Datenschutz-Grundverordnung (DSGVO)
- Begriffsbestimmung: Artikel 4, Nr. 14 und Nr. 15
- Bedingungen für die Einwilligung: Artikel 7
- Verarbeitung besonderer Kategorien personenbezogener Daten: Artikel 9
- Rechte der betroffenen Person: Artikel 12 bis 23
Fachartikel (Auswahl)
Schuol, S, Winkler EC. Umgang mit genomischen Daten in der klinischen Forschung aus ethischer Sicht. Forum 31, 402–405 (2016). doi.org/10.1007/s12312-016-0124-7.