- Eine Antikörpertherapie wirkt gegen bestimmte Zielstrukturen im Körper. Sie soll gezielt Krebszellen bekämpfen.
- Es gibt bereits viele unterschiedliche zugelassene Medikamente mit Antikörpern. Sie kommen häufig für Krebserkrankte mit fortgeschrittener Erkrankung infrage.
- Dieser Text erläutert, was eine Antikörpertherapie ist, wer sie bekommen kann, wie sie abläuft und welche Nebenwirkungen auftreten können.
Antikörpertherapie bei Krebs: Was ist das?
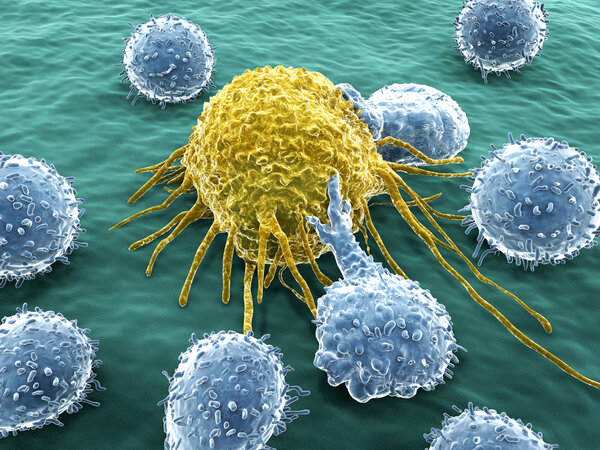
Eine Antikörpertherapie ist etwas anderes als eine Chemotherapie. Die Chemotherapie richtet sich gegen schnell wachsende Zellen, zu denen auch Krebszellen gehören. Die Antikörpertherapie dagegen richtet sich gegen ein bestimmtes Merkmal der Tumorzellen.
Antikörper sind große Eiweißmoleküle. Sie sind normalerweise Teil der körpereigenen Immunabwehr. Sie erkennen sehr passgenau eine bestimmte Zielstruktur, zum Beispiel auf Krankheitserregern oder auf kranken Körperzellen. Sie binden an diese und aktivieren dann das Immunsystem. Außerdem blockieren sie die Andockstelle, sodass andere Stoffe nicht mehr daran binden können.
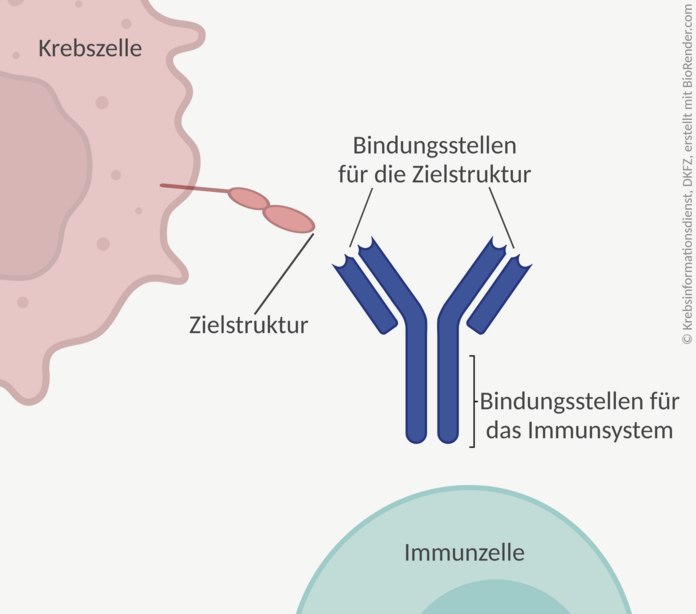
Bild: © Krebsinformationsdienst, DKFZ, erstellt mit BioRender.com
Diese Eigenschaften nutzen Ärztinnen und Ärzte in der Krebsbehandlung. Zielstrukturen sind dabei Merkmale, die typisch für Krebszellen sind und auf anderen Zellen nicht oder nur wenig vorkommen. Fachleute sprechen von Tumorantigenen.
Lexikon
Tumorantigen: Eiweiß, das von Tumorzellen gebildet wird, aber nicht oder nur wenig von normalen Körperzellen. Kann von Antikörpern erkannt werden.
monoklonale Antikörper: baugleiche Antikörper, die alle dasselbe Eiweiß erkennen.
Bei der Antikörpertherapie werden künstlich hergestellte Antikörper verwendet, sogenannte monoklonale Antikörper. Sie sind alle baugleich und erkennen daher alle dieselbe Zielstruktur. Der Wirkstoffname dieser Medikamente endet häufig (aber nicht immer) auf …mab, wie zum Beispiel bei Trastuzumab.
Je nach Zielstruktur wirken die Antikörper unterschiedlich:
- als Immuntherapie: Durch Bindung an die Zielstruktur aktivieren die Antikörper hauptsächlich das Immunsystem und bringen es dazu, den Tumor selbst zu bekämpfen. Ein Beispiel für solche Antikörper sind Checkpoint-Inhibitoren. Sie hemmen Bremsen des Immunsystems. Ein anderes sind sogenannte bispezifische Antikörper mit 2 verschiedenen Bindungsstellen. Sie lenken Immunzellen zu den Tumorzellen und zählen deshalb ebenfalls zu den Immuntherapien.
- als zielgerichtete Krebstherapie: In diesem Fall blockieren die Antikörper hauptsächlich ihre Zielstruktur. Solche Antikörper hemmen zum Beispiel die Bindung von Botenstoffen an die jeweilige Andockstelle. Sie können so Signale blockieren, die Krebszellen zum Wachstum anregen. Oder sie verhindern die Blutgefäßneubildung, die der Versorgung des Tumors dient.
Zum Weiterlesen
Wer bekommt eine Antikörpertherapie?
Antikörpertherapien sind für die Behandlung vieler verschiedener Tumorarten zugelassen, beispielsweise für Patientinnen und Patienten mit Brust-, Lungen-, oder Darmkrebs, Melanom und Leukämie.
Die meisten Medikamente eignen sich zur Behandlung einer fortgeschrittenen Erkrankung, die nicht mehr heilbar ist. Sie können dann das Fortschreiten der Erkrankung aufhalten und Beschwerden lindern. Bei manchen Betroffenen kommt eine Antikörpertherapie aber auch in einem früheren Krankheitsstadium infrage, beispielsweise, um das Rückfallrisiko nach einer erfolgreichen Erstbehandlung weiter zu senken.
Ob Krebserkrankte eine bestimmte Antikörpertherapie bekommen können, hängt auch von den Eigenschaften ihres Tumors ab – also davon, ob die Zielstruktur des Antikörpers auf den Tumorzellen (vermehrt) vorhanden ist oder nicht.
Ärztinnen und Ärzte messen solche sogenannten Biomarker am Tumorgewebe aus einer Biopsie oder einer Operation. Die Tumorzellen werden dafür unter dem Mikroskop oder mit molekularbiologischen Methoden untersucht.
Ablauf einer Antikörpertherapie
Eine Antikörpertherapie können die meisten Patientinnen und Patienten ambulant erhalten. Die Medikamente bekommen die Betroffene üblicherweise als Infusion in eine Vene. Diese Infusionen finden in festgelegten Abständen statt, je nach Medikament zum Beispiel wöchentlich, alle 2 oder alle 3 Wochen. Eine einzelne Infusion dauert in der Regel eine halbe bis 2 Stunden.
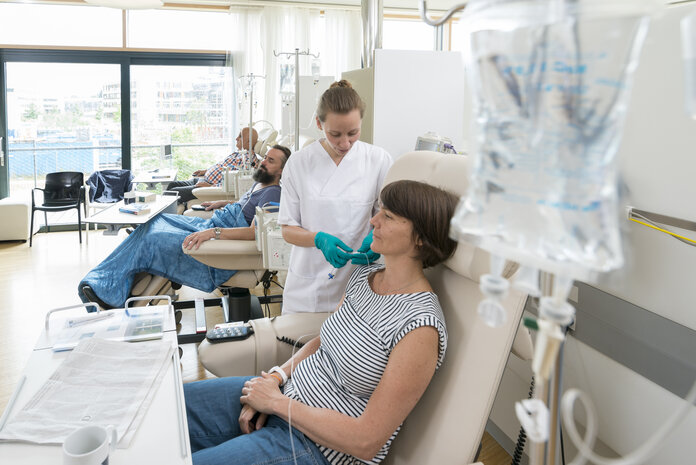
Bild: © Krebsinformationsdienst, DKFZ; Foto: Tobias Schwerdt
Manche Medikamente können Krebserkrankte auch als Spritze unter die Haut bekommen.
Je nach Krankheitssituation können verschiedene Antikörpertherapien miteinander kombiniert werden. Oder eine Antikörpertherapie wird mit anderen Therapieformen kombiniert, etwa einer Strahlen- oder Chemotherapie.
Betroffene mit fortgeschrittener Erkrankung erhalten die Medikamente in der Regel solange, wie sie wirken oder bis zu starke Nebenwirkungen auftreten. In frühen Krankheitsstadien hängt die Behandlungsdauer vom Medikament und der Krebsart ab.
Fragen Sie Ihre Ärzte
Krebserkrankte sollten mit ihren Ärztinnen und Ärzten besprechen, wie ihre individuelle Behandlung konkret geplant ist.
Mögliche Nebenwirkungen
Bei einer Antikörpertherapie können Nebenwirkungen auftreten. Welche das sind, hängt vom jeweiligen Medikament ab, das Patientinnen oder Patienten bekommen.
- Handelt es sich um eine Immuntherapie, sind vor allem überschießende Immunreaktionen möglich, zum Beispiel Fieber, Ausschläge und Entzündungen.
- Bei einer zielgerichteten Therapie hängen mögliche Nebenwirkungen vor allem davon ab, ob und auf welchen körpereigenen gesunden Zellen die Zielstruktur vorkommt. Möglich sind zum Beispiel Nebenwirkungen an Haut, Haaren und Nägeln oder im Herz-Kreislauf-System. Auch Fehlfunktionen von Schilddrüse oder Leber und Durchfall sind mögliche Probleme.
Einigen Nebenwirkungen kann man vorbeugen oder man kann sie behandeln. Selten sind die Nebenwirkungen so stark, dass Patientinnen oder Patienten die Therapie unterbrechen oder ganz abbrechen müssen.
Fragen Sie uns!
Haben Sie Fragen zu Ihrer Erkrankungssituation oder zu einem bestimmten Medikament und seinen Nebenwirkungen?
Gerne stehen unsere Ärztinnen und Ärzte Ihnen kostenfrei mit Hintergrundinformationen für Ihre individuelle Situation zur Verfügung:
- am Telefon täglich von 8 bis 20 Uhr unter 0800 420 30 40
- über ein datensicheres Kontaktformular oder per E-Mail an krebsinformationsdienst@dkfz.de
Biosimilars: Wirken sie genauso gut?
Inzwischen gibt es für mehrere Antikörpertherapien Nachahmer-Präparate von anderen Firmen. Fachleute nennen sie Biosimilars.
Biosimilars sind etwas Anderes als Generika: Ein Generikum ist das Nachahmer-Präparat eines chemischen Wirkstoffs und enthält genau den gleichen Wirkstoff wie das Ursprungs-Präparat. Ein Biosimilar dagegen ist dem ursprünglichen Arzneimittel lediglich ähnlich, aber nicht genau gleich.
Denn es handelt sich um das Nachahmer-Präparat eines biologischen Arzneimittels, zum Beispiel einer Antikörpertherapie. Biologische Arzneimittel werden anders hergestellt als chemische Wirkstoffe. Sie entstehen in lebenden Zellen und haben einen sehr komplexen Aufbau.
Ein Nachahmer-Antikörper bindet beispielsweise an dieselbe Zielstruktur, hat also dieselbe Bindungsstelle wie im Ursprungs-Arzneimittel. Der restliche Aufbau unterscheidet sich aber etwas vom ursprünglichen Präparat.
Weil sie nicht exakt gleich sind, müssen Biosimilars einen aufwendigeren Zulassungsprozess durchlaufen als Generika. Die Herstellerfirma muss in Studien nachweisen, dass sie gleichwertig zum Original-Präparat sind.
Ist ein Wechsel zu einem Biosimilar während der Therapie möglich? Ja, prinzipiell ist das möglich. Die Ärztin oder der Arzt sollte dann aber ausführlich darüber informieren, warum das sinnvoll ist und was das für Patientinnen und Patienten bedeutet. Fachleute empfehlen außerdem, Betroffene in der ersten Zeit nach der Umstellung sorgfältig ärztlich zu überwachen.
Forschung zu neuen Ansätzen
Bisher sind nicht für alle Krebsarten und Krankheitsstadien Antikörpertherapien zugelassen. Außerdem gibt es verschiedene Ansätze, die Therapie weiter zu verbessern. Wenn Forscherinnen und Forscher beispielsweise neue Zielstrukturen finden, die wirklich nur auf Tumorzellen vorkommen, könnten Nebenwirkungen verringert werden.
Bei vielen Betroffenen kommt es außerdem nach einiger Zeit zu Resistenzen. Das bedeutet, die Therapie wirkt nicht mehr, weil die Krebszellen sich verändert haben. Wissenschaftlerinnen und Wissenschaftler versuchen auf verschiedenen Wegen, solche Resistenzen zu verhindern. Beispielweise testen sie Kombinationen verschiedener Antikörpertherapien oder kombinieren sie mit anderen Behandlungsmethoden.
Ein weiteres Problem: Antikörper sind vergleichsweise große Moleküle und gelangen oft nicht in ausreichender Menge an ihr Ziel im Körper. Deshalb entwickeln Forscherinnen und Forscher zum Beispiel kleinere Moleküle, die aus Antikörperstücken bestehen.

Bild: © Julia Koblitz, Unsplash
Sind solche Wirkstoffe schon relativ weit entwickelt, dann werden sie in klinischen Studien am Menschen getestet. Wer wissen möchte, ob in der persönlichen Krankheitssituation eine Studie infrage kommt, sollte die behandelnden Ärztinnen und Ärzte fragen und sich erklären lassen, welche Vor- und Nachteile eine Studie hat.
Zum Weiterlesen
Quellen und Links für Interessierte und Fachkreise
Im Folgenden finden Sie eine Auswahl an hilfreichen Links zum Weiterlesen und Quellen, die für die Erstellung dieses Textes genutzt wurden.
Leitlinien
Leitlinien zur Therapie verschiedener Krebsarten finden sich beim Leitlinienprogramm Onkologie der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V. (AWMF), der Deutschen Krebsgesellschaft e. V. (DKG) und der Deutschen Krebshilfe (DKH). Dort ist jeweils beschrieben, ob und welche Antikörpertherapien infrage kommen.
Arzneimittel: Herstellerinformationen, Studien, Nutzenbewertungen
Als Quelle für Aussagen zu Medikamenten hat der Krebsinformationsdienst aktuelle Fachinformationen der Hersteller herangezogen (über www.fachinfo.de/ für Fachkreise zugänglich). Außerdem greift der Krebsinformationsdienst auf frei zugängliche Informationen zu, wie
- Arzneimittelinformationen in deutschen Datenbanken, vor allem im Arzneimittel-Informationssystem des Bundes PharmNet.Bund.
- aktuelle Hinweise des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) und des Paul-Ehrlich-Instituts (PEI).
- die Informationen der europäischen Arzneimittelbehörde EMA.
Zu neueren Arzneimitteln werden als Quelle auch Nutzenbewertungen gemäß § 35a des SGB V herangezogen. Die bisher vorliegenden Berichte sind abrufbar beim Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) unter dem Stichwort "Projekte", dann "Projekte & Ergebnisse". Auch der Gemeinsame Bundessausschuss (G-BA) bietet Informationen zu Arzneimitteln. In der Regel handelt es sich dabei um Änderungen der Arzneimittel-Richtlinie.
Zugelassene Antikörpertherapien: Eine Liste der in Deutschland zur Behandlung von Patienten zugelassenen monoklonalen Antikörper ist auf den Internetseiten des Paul-Ehrlich-Instituts (PEI) zusammengestellt.
Fachartikel (Auswahl)
Carter PJ, Rajpal A. Designing antibodies as therapeutics. Cell. 2022 Jul 21;185(15):2789-2805. doi: 10.1016/j.cell.2022.05.029.
Delgado M, Garcia-Sanz JA. Therapeutic Monoclonal Antibodies against Cancer: Present and Future. Cells. 2023 Dec 14;12(24):2837. doi: 10.3390/cells12242837.
Klein C, Brinkmann U, Reichert JM, Kontermann RE. The present and future of bispecific antibodies for cancer therapy. Nat Rev Drug Discov. 2024 Apr;23(4):301-319. doi: 10.1038/s41573-024-00896-6.
Kumar M, Jalota A, Sahu SK, Haque S. Therapeutic antibodies for the prevention and treatment of cancer. J Biomed Sci. 2024 Jan 12;31(1):6. doi: 10.1186/s12929-024-00996-w.
Paul S, Konig MF, Pardoll DM, Bettegowda C, Papadopoulos N, Wright KM, Gabelli SB, Ho M, van Elsas A, Zhou S. Cancer therapy with antibodies. Nat Rev Cancer. 2024 Jun;24(6):399-426. doi: 10.1038/s41568-024-00690-x.