Gliome: Die aktuelle Primärtherapie
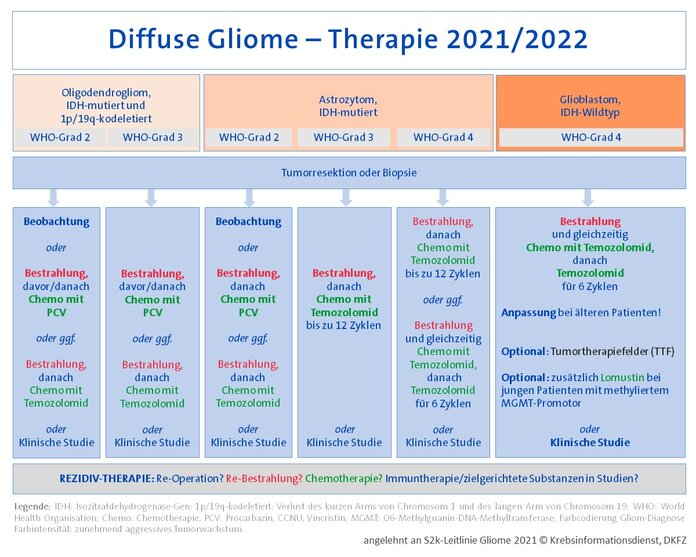
Bild: © Krebsinformationsdienst, DKFZ
Seit Mitte 2021 gibt es eine aktuelle Fassung der S2k-Leitlinie* für die Diagnostik und Therapie von Gliomen im Erwachsenenalter, herausgegeben von der Deutschen Gesellschaft für Neurologie (DGN). Sie umfasst alle wichtigen Informationen zu Diagnostik, Therapie, Nachsorge und Rehabilitation bei erwachsenen Patientinnen und Patienten mit Gliomen.
Die aktuellen Behandlungsstrategien für die einzelnen Gliome außerhalb klinischer Studien sind in der beigefügten Übersichts-Grafik in vereinfachter Form zusammengefasst. Wesentliche (neue) Eckpunkte sind:
Glioblastome:
- Die Radiochemotherapie, also die Strahlentherapie mit gleichzeitiger Temozolomid-Chemotherapie und die nachfolgende Temozolomid-Erhaltung über 6 Zyklen (sogenanntes "Stupp-Schema") bleiben zunächst Standard bei jüngeren Patienten mit Glioblastom.
- Ältere Patienten mit Glioblastom profitieren von besonderen Bestrahlungsschemata. Die weitere Behandlung kann je nach Methylguanin-DNA-Methyltransferase (MGMT)-Promotormethylierung angepasst werden.
- Elektrische Wechselfelder (TTF = Tumor Treating Fields) nach einer Radiochemotherapie und stabilem Verlauf verbessern das progressionsfreie Überleben und das Gesamtüberleben in der Erstlinie, so die Ergebnisse einer Phase-III-Studie. Bestätigende klinische Studien fehlen allerdings.
- Der Nitrosoharnstoff Lomustin (CCNU, Chlorethyl-Cyclohexyl-Nitroso-Urea) zusätzlich zu einer Radiochemotherapie mit Temozolomid verlängert möglicherweise das Überleben von Patienten mit neu diagnostizierten MGMT-Promotor-methylierten Glioblastomen. Die zugrundeliegenden Studiendaten werden jedoch kontrovers diskutiert.
IDH-mutierte Astrozytome und Oligodendrogliome:
- Behandlungsbedürftige Patienten mit IDH-mutiertem Astrozytom und Oligodendrogliom WHO-Grad 2 profitieren von einer Kombination aus Bestrahlung und anschließender Chemotherapie mit PCV (PCV = Procarbazin, CCNU, Vincristin) im Vergleich zu einer alleinigen Bestrahlung.
- Betroffene mit einem IDH-mutierten Astrozytom WHO-Grad 3 profitieren von einer Bestrahlung und anschließender Temozolomid-Erhaltung im Vergleich zu einer alleinigen Bestrahlung. Die Gabe von Temozolomid gleichzeitig (konkomitant) zur Bestrahlung ist vermutlich nicht von zusätzlichem Vorteil.
Gliome: Möglichkeiten im Rezidiv
Generell prüfen die behandelnden Ärztinnen und Ärzte bei einem fortschreitenden Gliom immer die Möglichkeit einer erneuten Operation und/oder einer Strahlentherapie. Bei einer Chemotherapie im Rezidiv sind Nitrosoharnstoffe (CCNU) oder Temozolomid laut S2k-Leitlinie Medikamente der ersten Wahl. Weitere Optionen sind gegebenenfalls zielgerichtete Medikamente – wenn möglich im Rahmen klinischer Studien.
Die S2k-Leitliniengruppe betont darüber hinaus:
- Bevacizumab und Lomustin können in Kombination die progressionsfreie Überlebenszeit verlängern. Für das Gesamtüberleben konnte das in der entsprechenden klinischen Studie aber nicht gezeigt werden.
- Bei Patienten mit MGMT-Promotor-unmethyliertem Glioblastom sollte sowohl in der Primär- als auch in der Rezidivsituation die Option einer erweiterten molekularen Diagnostik diskutiert werden. Gegebenenfalls können Betroffene dann an einer klinischen Studie teilnehmen oder ein zielgerichtetes Medikament erhalten, das bereits bei anderen Tumoren zugelassen ist.
- Wächst ein Glioblastom nachweislich unter einer Behandlung, soll die laufende tumorspezifische Therapie nicht weiter fortgeführt werden.
Aus Gliom-Studien lernen
Ärztinnen und Ärzte forschen in zahlreichen vorklinischen und klinischen Studien daran, wie sie einzelne Gliome in ihrem Wachstum effektiv stoppen können. In Zukunft wollen sie so wirksame und zielgenaue Therapien für diese aggressiven Hirntumoren entwickeln und bereitstellen. Einige der bereits geprüften Therapien haben sich beim Gliom als nicht ausreichend wirksam erwiesen. Daher ist wichtig:
- Verfahren, die sich beim Gliom in Studien klar als nicht hilfreich erwiesen haben, sollten bei betroffenen Patientinnen und Patienten auch nicht eingesetzt werden.
- Wenn immer möglich, sollten neue vielversprechende Behandlungsverfahren bei Gliomen zunächst im Rahmen klinischer Studien eingesetzt werden – das gilt sowohl in der Primärtherapie als auch in der Rezidivsituation.
Neue Therapieansätze bei Gliompatienten
Noch fehlen verlässliche Studiendaten, um für einige der neu definierten Gliomtypen evidenzbasiert Therapieentscheidungen zu treffen. Für den einzelnen Betroffenen müssen Ärztinnen und Ärzte daher immer individuell abwägen, welcher Behandlungsansatz gewählt werden kann.
Zielgerichtete Ansätze sind bislang beim Gliom selten: Bei Gen-Panel-Sequenzierungen und anderen DNA- oder RNA-basierten Methoden finden Fachleute bei Gliompatienten bislang nur sehr selten genetische Veränderungen, die zielgenau therapiebar sind. Eine Ausnahme sind BRAF-Mutationen oder seltene NTRK-Fusionen. In einer klinischen Studie wird zudem derzeit der IDH-Hemmstoff Vorasidenib bei Gliomen WHO-Grad 2 mit IDH1/2-Mutation untersucht (INDIGO-Studie).
Innovative Studienkonzepte sind schon etabliert: In Umbrella-Studien erhalten Glioblastombetroffene je nach vorliegendem Biomarker unterschiedliche zielgerichtete Erstlinien-Therapien. Ein Beispiel ist die deutsche N2M2 (Neuro Master Match)-Studie der Neuroonkologischen Arbeitsgemeinschaft (NOA). Aufgenommen werden hier Patienten mit neu diagnostiziertem Glioblastom ohne Hypermethylierung des MGMT-Promotors. Auch im Rahmen der internationalen GBM-AGILE-Plattform (Glioblastoma Adaptive Global Innovative Learning Environment) werden verschiedene Wirkstoffe in der Primär- und Rezidivtherapie des Glioblastoms untersucht.
Hoffnungsträger Immuntherapie: Auch bei Gliomen forschen Ärzteteams an verschiedenen immuntherapeutischen Ansätzen und Impfkonzepten. Bei diesen Hirntumoren ist das aus mehreren Gründen schwieriger als bei den meisten anderen Tumorerkrankungen. Viele Strategien werden derzeit in vorklinischen Studien untersucht.
In kleinen frühen klinischen Studien werden in Deutschland beispielsweise folgende Immuntherapien bei erwachsenen Gliompatienten geprüft:
- Eine IDH1-Peptidvakzine in Kombination mit dem Checkpoint-Hemmer Avelumab bei Gliomen mit IDH1/2-Mutation (NOA-16)
- Die Multipeptid-Vakzine XS15 zusätzlich zur Radiochemotherapie in der Primärtherapie des Glioblastoms (GLIO-XS15)
- Eine Impfung mit patienteneigenen, mit Tumor-Lysat behandelten dendritischen Zellen zusätzlich zur Radiochemotherapie in der Primärtherapie des Glioblastoms (GlioVax-Studie)
- Der Multipeptid-Impfstoff EO2401 mit und ohne Immun-Checkpoint-Blockade in der Rezidivtherapie des Glioblastoms (ROSALIE)
Wichtig zu wissen
Erster Ansprechpartner für Fragen zur Therapie und zur Teilnahme an einer klinischen Studie ist das behandelnde Fachärzteteam. Die Kollegen kennen alle wesentlichen Tumorbefunde und den aktuellen Gesundheitszustand der betroffenen Patientin beziehungsweise des betroffenen Patienten. Und sie können gegebenenfalls auch den Kontakt zu einem entsprechenden Studienzentrum vermitteln.
Allgemeine Informationen zur Studiensuche bei Krebspatienten hat krebsinformationsdienst.med zudem aktuell zusammengestellt.
Zum Weiterlesen: Verwendete Quellen und vertiefende Informationen
Leitlinien und systematische Übersichtsarbeiten
* S2k-Leitlinie Gliome, Stand 2021: Wick W et al. Gliome, S2k-Leitlinie, 2021, in: Deutsche Gesellschaft für Neurologie (Hrsg.), Leitlinien für Diagnostik und Therapie in der Neurologie. Online: www.dgn.org/leitlinien (abgerufen am 8.3.2022)
EANO Guideline 2021: Weller M, van den Bent M, Preusser M, Le Rhun E, Tonn JC, Minniti G, Bendszus M, Balana C, Chinot O, Dirven L et al. EANO guidelines on the diagnosis and treatment of diffuse gliomas of adulthood. Nat Rev Clin Oncol 2021; 18: 170–186. doi: 10.1038/s41571-020-00447-zs.
DGHO-Leitlinie Gliome im Erwachsenenalter, Stand 2021: Hofer S, Bullinger L, Dierlamm J, Grosu AL, Hau P, Hense J, Hoffmann J, Proescholdt M, Pflugshaupt T, Preusser M et al. https://www.onkopedia.com/de/onkopedia/guidelines/gliome-im-erwachsenenalter/@@guideline/html/index.html (abgerufen am 8.3.2022)
ASCO-SNO Guideline 2022: Mohile NA, Messersmith H, Gatson NT, Hottinger AF, Lassman A, Morton J, Ney D, Nghiemphu PL, Olar A, Olson J et al. Therapy for Diffuse Astrocytic and Oligodendroglial Tumors in Adults: ASCO-SNO Guideline. J Clin Oncol. 2022 Feb 1;40(4):403-426. doi: 10.1200/JCO.21.02036.
Weitere Übersichtsarbeiten und Fachveröffentlichungen
Yaghi NK, Gilbert MR. Immunotherapeutic Approaches for Glioblastoma Treatment. Biomedicines. 2022; 10(2):427. doi.org/10.3390/biomedicines10020427.
