So funktioniert die CAR-T-Zell-Therapie
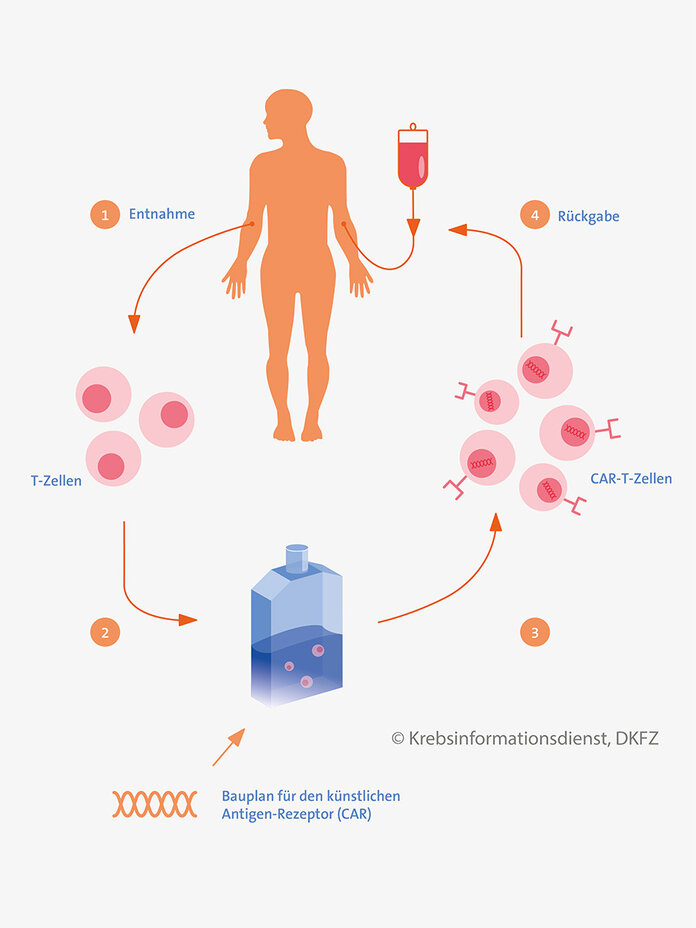
Für die Herstellung werden mithilfe einer Leukapherese T-Zellen aus dem Blut des Patienten gewonnen. Die Zellen werden an ein Herstellerlabor verschickt und dort gentechnisch verändert.
Ein neues Gen wird eingebaut
Mithilfe eines Virus oder spezieller anderer Verfahren wird ein neues Gen stabil eingebaut, das T-Zellen normalerweise nicht haben. Dieses Gen ist der Bauplan für ein spezifisches Protein, das als künstlicher (chimärer) Antigenrezeptor (CAR) bezeichnet wird.
Die modifizierten T-Zellen werden zur Vermehrung angeregt und dann an das Behandlungszentrum zurückgeschickt. Dort erhält der Patienten die CAR-T-Zellen über eine Infusion wieder zurück.
Mithilfe des künstlichen Antigenrezeptors erkennen die CAR-T-Zellen gezielt die Zellen, die das entsprechend passende Antigen exprimieren. Durch den Kontakt mit den CAR-T-Zellen werden diese Zellen abgetötet.
Zusätzlich Chemotherapie
Vor der Rückgabe der CAR-T-Zellen wird in der Regel eine intensive Chemotherapie durchgeführt, eine sogenannte lymphodepletierende Konditionierungstherapie. Dadurch werden nicht nur Tumorzellen, sondern auch das körpereigene Immunsystem zurückgedrängt: Die CAR-T-Zellen können sich nach der Rückgabe dann effektiver im Körper des jeweiligen Patienten vermehren.
CD19-spezifische CAR-T-Zellen – gute Wirksamkeit, ernstzunehmende Nebenwirkungen
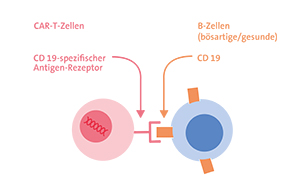
Bild: Krebsinformationsdienst, Deutsches Krebsforschungszentrum
Für die CAR-T-Zell-Behandlung von B-Zell-Leukämien und B-Zell-Lymphomen wurde ein CD19-spezifischer chimärer Antigenrezeptor (CAR) konstruiert. Denn: Das Antigen CD19 ist auf fast allen B-Lymphozyten vorhanden. Ziel der CD19-spezifischen CAR-T-Zellen sind damit sowohl bösartig veränderte B-Lymphozyten als auch gesunde B-Lymphozyten.
Gute Wirksamkeit in klinischen Studien
Erste Studiendaten zu Tisagenlecleucel und Axicabtagen Ciloleucel legen nahe, dass die Behandlung bei vorbehandelten Patienten mit B-Zell-Leukämien/Lymphomen durchgeführt werden kann und wirksam ist: Bei den meisten Patienten spricht die Erkrankung sehr gut auf die Therapie an – und bei etlichen ist der Therapieerfolg dauerhaft. Die Behandlung ist bisherigen Erfahrungen zufolge besser wirksam, wenn nicht zu viele Leukämie- bzw. Lymphomzellen vorhanden sind (low tumor burden).
Nebenwirkungen der CD19-spezifischen CAR-T-Zellen
Weitere Informationen zu Wirksamkeit und Nebenwirkungen
Die Ergebnisse der Zulassungsstudien im Hinblick auf Wirksamkeit und Nebenwirkungen können in Kürze der Internetseite der Europäischen Zulassungsbehörde (EMA, http://www.ema.europa.eu/ema/) entnommen werden. Die Zulassungsmeldungen finden sich auf der Seite der EU-Kommission für
Tisagenlecleucel unter http://ec.europa.eu/health/documents/community-register/html/h1297.htm und für
Axicabtagen Ciloleucel unter http://ec.europa.eu/health/documents/community-register/html/h1299.htm.
Bei so gut wie allen Patienten kommt es unter einer CD19-spezifischen CAR-T-Zell-Therapie zu – teilweise schwerwiegenden – Nebenwirkungen. Patienten, die eine solche Behandlung erhalten, müssen daher intensiv betreut werden. Nur so können Nebenwirkungen frühzeitig festgestellt und behandelt werden.
Zytokin-Freisetzungs-Syndrom
Am häufigsten ist das sogenannte Zytokin-Freisetzungs-Syndrom (cytokine release syndrome, CRS), eine Art "Überreaktion" des Immunsystems, bei der verstärkt Zellbotenstoffe (Zytokine) gebildet werden.
Ein CRS kann mit milden Beschwerden einhergehen – ähnlich einer Grippe – aber auch akut lebensbedrohlich sein. Behandelbar ist es unter anderem mit dem bald auch für diese Indikation zugelassenen monoklonalen Antikörper Tocilizumab.
B-Zell-Aplasie
Das CD19-Antigen wird auch auf gesunden B-Zellen exprimiert. Daher sind bei Patienten, deren Erkrankung auf die CD19-CAR-T-Zell-Therapie anspricht, nach der Behandlung praktisch keine gesunden B-Zellen mehr nachweisbar. Da dann auch keine Immunglobuline mehr gebildet werden (Hypogammaglobulinämie), erhalten die meisten Patienten regelmäßig Immunglobulin-Infusionen.
CD19-spezifische CAR-T-Zellen: Gemeinsamkeiten und Unterschiede
Tisagenlecleucel und Axicabtagen Ciloleucel sind für unterschiedliche Indikationen zugelassen worden. Grund dafür sind vor allem die in den Zulassungsstudien schwerpunktmäßig untersuchten Patientengruppen. Inwieweit sind die CD19-spezifischen Produkte vergleichbar, wo können Unterschiede vorliegen?
Wirksamkeit von vielen Faktoren abhängig
Der Wirkmechanismus verschiedener CD19-spezifischer CAR-T-Zellen ist im Prinzip vergleichbar. Wie effektiv und anhaltend sie wirken, ist jedoch von vielen verschiedenen Faktoren abhängig. Wichtig sind zum einen – neben der Erkrankungssituation per se – die Art der Konditionierungstherapie und die Menge der eingesetzten CAR-T-Zellen. Darüber hinaus sind auch der genaue Aufbau des chimären Antikörperrezeptors (CAR) sowie die Art der Herstellung entscheidend für die Wirksamkeit.
Unterschiede im Aufbau und bei der Herstellung des CARs
- Bei der Herstellung und im Aufbau können sich einzelne Produkte deutlich voneinander unterscheiden. Direkte Vergleiche einzelner CD-19-CAR-T-Zell-Produkte gibt es nicht. Die T-Zellen des Patienten können nach der Entnahme im Labor auf unterschiedliche Art und Weise aufbereitet werden, bevor sie modifiziert werden.
- Ein CAR hat neben der antigenerkennenden Region weitere Abschnitte: Sie sind für die Verankerung und Präsentation des Rezeptors zuständig und leiten Aktivierungssignale an die T-Zelle weiter. Diese Abschnitte können aus unterschiedlichen Komponenten aufgebaut sein.
- Das Gen für den CAR kann mithilfe eines Virus oder mit anderen Verfahren in die T-Zellen eingebaut werden.
- Die modifizierten T-Zellen können im Labor auf unterschiedliche Art und Weise vervielfältigt werden, bevor sie dem Patienten zurückgegeben werden.
Praktische Aspekte der CAR-T-Zell-Therapie
Tisagenlecleucel und Axicabtagen Ciloleucel werden voraussichtlich nur in wenigen, von den Herstellerfirmen ausgewiesenen Laboren in Europa zentral hergestellt. Dafür müssen die patienteneigenen Zellen nach der Abnahme und vor der Rückgabe gegebenenfalls über längere Strecken transportiert werden.
Qualitätsstandards sichern den Ablauf
Sowohl für den Transport als auch für den eigentlichen Herstellungsprozess gibt es klar vorgeschriebene Qualitätsstandards. Ähnliches gilt auch für die beteiligten Kliniken, in denen Patienten mit CAR-T-Zellen behandelt werden. Welche onkologischen Zentren in Deutschland eine Behandlung mit Tisagenlecleucel und Axicabtagen Ciloleucel anbieten werden, muss abgewartet werden. Ansprechpartner sind neben größeren onkologischen Zentren die Hersteller des entsprechenden CAR-T-Zell-Produktes.
CAR-T-Zelltherapie: In Zukunft auch gegen solide Tumoren?
Tisagenlecleucel und Axicabtagen Ciloleucel wurden für die Behandlung von B-Zell-Erkrankungen entwickelt. Bei soliden Tumoren ist eine entsprechende CAR-T-Zell-Therapie noch nicht etabliert.
B-Zell-Leukämien/Lymphome bieten guten Angriffspunkt für eine CAR-T-Zell-Therapie
Mit CD19 gibt es bei B-Zell-Leukämien/Lymphomen ein Antigen, das von allen Tumorzellen exprimiert wird. Außer bei gesunden B-Zellen kommt es in anderen Geweben/Organen aber nicht vor. Darüber hinaus sind die Tumorzellen in Blut, Knochenmark und Lymphknoten für die CAR-T-Zellen gut "erreichbar".
Bei soliden Tumorerkrankungen ist die Situation komplizierter
Bislang sind nur wenige Antigene auf Tumorzellen solider Tumoren bekannt, die sich als Ziel für eine CAR-T-Zell-Therapie eignen. Viele solide Tumoren sind darüber hinaus in sich sehr heterogen – eine CAR-T-Zelle trifft also häufig nur einen Teil der Tumorzellen. Dazu kommt, dass solide Tumoren oft von Zellen umgeben sind, die das Immunsystem hemmen.
Klinische Studien laufen
Für die CAR-T-Zell-Therapie solider Tumoren werden derzeit geeignete Antigene, neue Herstellungstechniken, Kombinationstherapien sowie regionale Applikationsformen erforscht. Erste Studien mit verschiedenen CAR-T-Zellen laufen beispielsweise bei Patienten mit Lungenkarzinom, Mesotheliom, Glioblastom oder Sarkom.
Zum Weiterlesen: Verwendete Quellen und vertiefende Informationen
Quellen
EU-Kommsion zu Tisagenlecleucel unter: http://ec.europa.eu/health/documents/community-register/html/h1297.htm
EU-Kommssion zu Axicabtagen Ciloleucel unter: http://ec.europa.eu/health/documents/community-register/html/h1299.htm.
Fachartikel
Ghorashian S, Amrolia P, Veys P. Open access? Widening access to chimeric antigen receptor (CAR) therapy for ALL. Exp Hematol. 2018 Jul 20. pii:S0301-472X(18)30634-9. doi: 10.1016/j.exphem.2018.07.002.
Jain MD, Bachmeier CA, Phuoc VH, Chavez JC. Axicabtagene ciloleucel (KTE-C19), an anti-CD19 CAR T therapy for the treatment of relapsed/refractory aggressive B-cell non-Hodgkin's lymphoma. Ther Clin Risk Manag. 2018 May 31;14:1007-1017. doi: 10.2147/TCRM.S145039.
June CH, O'Connor RS, Kawalekar OU, Ghassemi S, Milone MC. CAR T cell immunotherapy for human cancer. Science. 2018 Mar 23;359(6382):1361-1365. doi:10.1126/science.aar6711.
Köhl U, Arsenieva S, Holzinger A, Abken H. CAR T Cells in Trials: Recent Achievements and Challenges that Remain in the Production of Modified T Cells for Clinical Applications. Hum Gene Ther. 2018 May;29(5):559-568. doi:10.1089/hum.2017.254.
Shank BR, Do B, Sevin A, Chen SE, Neelapu SS, Horowitz SB. Chimeric Antigen Receptor T Cells in Hematologic Malignancies. Pharmacotherapy. 2017.Mar;37(3):334-345. doi: 10.1002/phar.1900.
Pang Y, Hou X, Yang C, Liu Y, Jiang G. Advances on chimeric antigen receptor-modified T-cell therapy for oncotherapy. Mol Cancer. 2018 May 16;17(1):91. doi: 10.1186/s12943-018-0840-y.
Zhang LN, Song Y, Liu D. CD19 CAR-T cell therapy for relapsed/refractory acute lymphoblastic leukemia: factors affecting toxicities and long-term efficacies. J Hematol Oncol. 2018 Mar 15;11(1):41. doi: 10.1186/s13045-018-0593-5.
Rechtlicher Rahmen/Behördeninformationen
Mit Tisagenlecleucel und Axicabtagen Ciloleucel wurden von der europäischen Zulassungsbehörde (EMA) erstmals Medikamente über ein neues Verfahren, PRIority MEdicines ("PRIME"), zugelassen. Damit sollen Medikamente in Zukunft schneller und effektiver zur Zulassung gelangen. Weiterführende Informationen beitet die EMA in einem Fact Sheet an: www.ema.europa.eu/ema/pages/includes/document/open_document.jsp?webContentId=WC500202670 (PDF)